Сколько ип: Сколько стоит обслуживание ИП в год в 2023
ИП без дохода: сколько платить налогов?
Часто бывает, что человек регистрирует ИП, но бизнес так и не начинает. Главное, что нужно знать — даже у неработающего предпринимателя копится долг по ежегодным страховым взносам. Другие долги на неактивном ИП бывают не всегда. Но мы побудем параноиками и расскажем, как проверить все возможные.
Чтобы остановить накопление долга, надо закрыть ИП. С конца 2020 года налоговая делает это сама. Но при таком исходе человеку запретят быть предпринимателем на три года.
Теперь обо всем по порядку.
У неработающего ИП всегда копится долг по страховым взносам
ИП без сотрудников платит страховые взносы за себя для получения пенсии по старости и медицинской помощи по полису. Взносы идут в Пенсионный фонд и Фонд медицинского страхования. Но платят их в одно окно — в налоговую инспекцию.
Размер взносов для ИП без сотрудников складывается из двух частей. Фиксированная — ее государство устанавливает на каждый год. И дополнительная — ее платят в размере 1 % от дохода, превышающего 300 000₽. У неработающего ИП набегает именно фиксированная часть взносов за каждый год. Но налоговая может взыскать долг только за последние три года — это ограничение из ст. 113 НК РФ.
У неработающего ИП набегает именно фиксированная часть взносов за каждый год. Но налоговая может взыскать долг только за последние три года — это ограничение из ст. 113 НК РФ.
Фиксированная часть взносов за 2022 год составляет 42 211 ₽. Из неё 34 445 ₽ идёт в пенсионку и 8766 ₽ в медстрах. Размеры взносов за предыдущие годы можно посмотреть здесь. Посчитать сумму за все года существования ИП можно в калькуляторе на сайте налоговой. Если ИП открылся не в начале года, размер взносов уменьшается пропорционально календарным дням. Если закрылся до конца года — тоже. Это следует из ст. 430 НК РФ.
Сроки оплаты взносов такие. Фиксированную часть платят каждый год до 31 декабря. Дополнительную часть — до 1 июля следующего года. Когда ИП закрывается, долги оплачивают в течение 15 дней после снятия с учёта в налоговой. Так сказано в ст. 432 НК РФ.
За нарушение сроков уплаты взносов налоговая насчитывает пени. Размер — 1/300 ключевой ставки. Но больше тела долга пени насчитать не могут — ст.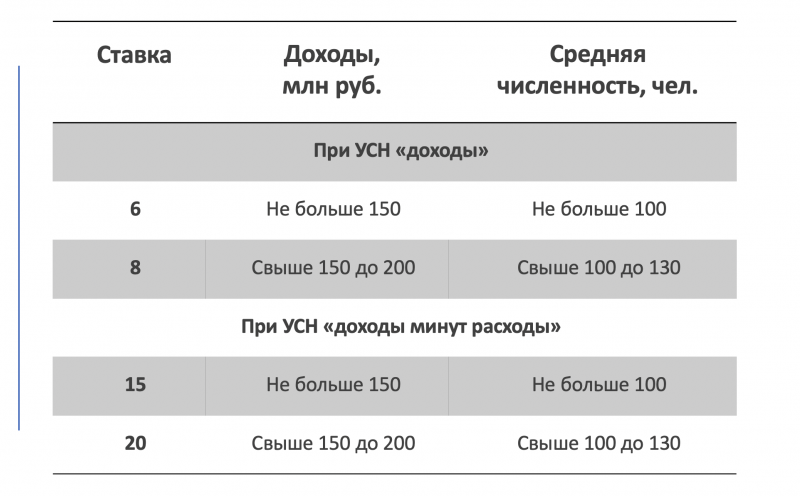 75 НК РФ.
75 НК РФ.
Калькулятор пени
Если ИП ничего не продавал, не отрывал счёт и не нанимал сотрудников, он всё равно платит страховые взносы. Предприниматели спрашивали, законно ли это, в Конституционном Суде. Там сказали так. Человек открывает ИП добровольно. Значит, у него есть необходимые деньги, образование и навыки, чтобы работать и выполнять налоговые обязательства — Определение № 164-О.
Однако всё же есть периоды, за которые страховые взносы можно не платить. Они прописаны в п. 7 ст. 430 НК РФ:
— служба в армии;
— уход за ребенком до 1,5 лет, но не больше 6 лет на всех детей;
— уход за инвалидом I группы, ребенком-инвалидом или за пожилым человеком старше 80 лет;
— период проживания с супругом в военной части или за границей в дипломатическом представительстве. но в пределах 5 лет.
Чтобы налоговая отменила взносы, надо принести документы, которые подтверждают эти обстоятельства. Автоматом начисления не отменят.
Другие жизненные обстоятельства вряд ли избавят от долга.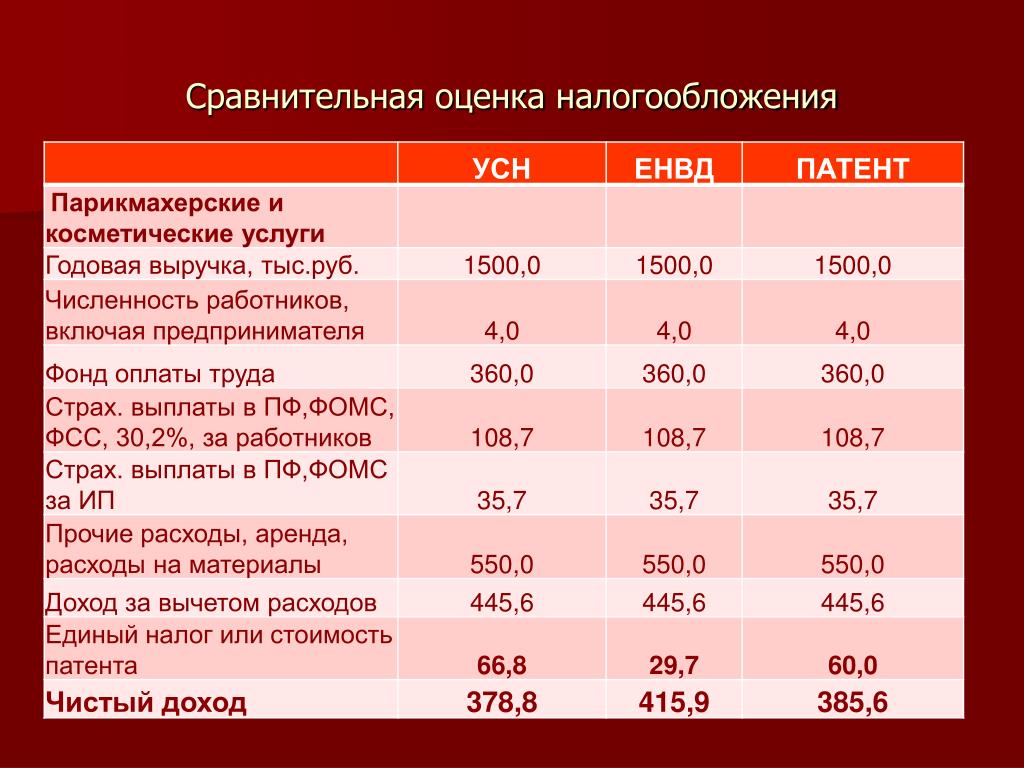 К примеру, суд отказался аннулировать взносы предпринимателю, который 6 лет сидел в тюрьме и не работал. Отказ объяснили тем, что даже из мест лишения свободы можно закрыть ИП через представителя, а не копить долг — дело № А34-10340/2019.
К примеру, суд отказался аннулировать взносы предпринимателю, который 6 лет сидел в тюрьме и не работал. Отказ объяснили тем, что даже из мест лишения свободы можно закрыть ИП через представителя, а не копить долг — дело № А34-10340/2019.
Если не было дохода, надо сдавать нулевую декларацию
Обычно предприниматель при регистрации выбирает спецрежим налогообложения — УСН или патент. Так делают, потому что на спецрежимах платят меньше налогов. Но если до заявления не дошли руки, ИП остается на общей системе налогообложения и платит НДФЛ, НДС и налог на имущество.
Единственный способ узнать свой налоговый режим — позвонить или сходить в налоговую.
Предприниматели на УСН и общей системе раз в год или квартал сдают в налоговую инспекцию декларацию, даже если не зарабатывали. Так перед инспекторами подтверждают, что дохода не было и налог платить не надо. Декларацию без дохода называют нулевой. За каждую несданную декларацию налоговая штрафует на 1000 ₽ по ст. 119 НК РФ. Но штрафовать можно только за три последних года.
Но штрафовать можно только за три последних года.
Штраф за несданные нулевые декларации плюсуется к долгу за неуплаченные страховые взносы и пени к ним.
🧮 Получается, что долг неработающего ИП перед налоговой — это сумма страховых взносов за последние три года + пени за просрочку уплаты + штрафы за декларации.
Как узнать про все долги ИП перед налоговой
Узнать полную и точную сумму долга можно, сходив лично в налоговую по месту жительства или через интернет-сервисы.
Посмотреть адрес своей налоговой и записаться на прием можно тут. На приёме у инспектора стоит запросить Справку о состоянии расчетов и Выписку операций по расчётам с бюджетом. По этим документам видно общую сумму долга и из-за каких платежей и штрафов она появилась.
Узнать про долги не выходя из дома и тут же погасить их можно в интернете:
— В разделе Налоговая задолженность через личный кабинет на Госуслугах;
— В личном кабинете ИП на сайте ФНС. Войти в кабинет можно через учетную запись с Госуслуг или с помощью ЭЦП, если она есть.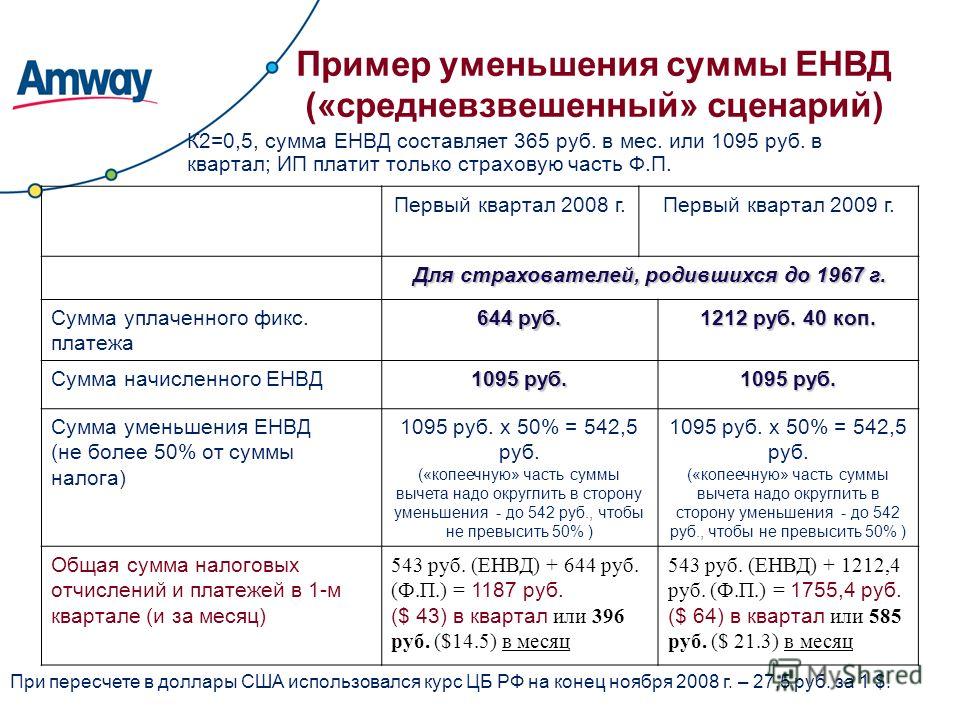
Долги по налогам не просто болтаются в личном кабинете ИП. Сначала налоговая присылает требование об уплате, а потом пытается списать деньги со всех известных счетов и личных карт предпринимателя. Инспекторам так можно — ст. 76 НК РФ.
Если инспекторы не находят деньги на счетах, долг передают судебным приставам. Те могут прийти домой и забрать имущество. Найти свое дело можно в банке данных исполнительных производств.
Новым ИП — год Эльбы в подарок
Год онлайн-бухгалтерии на тарифе Премиум для ИП младше 3 месяцев
Попробовать бесплатно
Судебные споры с участием ИП
Иногда ситуация с бизнесом развивается так. Открыли ИП, немного поработали, но бизнес не пошел, и все бросили.
Даже если предприниматель совсем недолго продавал товары или арендовал помещение, у него могли остаться долги перед клиентами и контрагентами. Досудебные претензии, которые они отправляли почтой, легко пропустить. И возможно, на предпринимателя уже подали в суд.
И возможно, на предпринимателя уже подали в суд.
Узнать о судебных делах с поставщиками, подрядчиками и арендодателями можно в картотеке арбитражных дел. Это база всех судебных споров между предпринимателями.
Если есть опасность, что к ИП остались претензии от клиентов-физлиц, стоит проверить базу судов общей юрисдикции в сервисе ГАС Правосудие.
Если обнаружили, что вы участник судебного дела, стоит сразу подключиться. Сходить в суд, сфотографировать в материалах исковое заявление и доказательства. Потом ходить на судебные заседания, спорить или попробовать пойти на мировое.
Как быть с ненужным ИП
Неработающее ИП стоит закрыть. Это остановит накопление долгов по взносам. Но сами долги никуда не денутся. Долги останутся висеть на физлице, и рано или поздно их придется гасить.
Если закрыть ИП самостоятельно, в будущем можно будет открыть новое. Закрыть ИП без сотрудников просто, быстро и почти бесплатно. Посмотрите об этом нашу статью.
Продать или переоформить ИП на другого человека нельзя.
Неработающие ИП налоговая закрывает сама, но это не всегда хорошо
С конца 2020 года налоговая сама закрывает неработающие ИП. Если говорить юридическим языком — исключает предпринимателя из единого госреестра по ст. 22.4 Закона № 129-ФЗ.
Неработающими считаются ИП при соблюдении двух условий:
— они дольше 15 месяцев не сдавали расчёты и декларации или не продлевали патент,
— есть непогашенный долг по налогам или взносам.
До исключения налоговая пробует найти кредиторов ИП. Для этого в журнале «Вестник государственной регистрации» публикуют сообщение о предстоящем закрытии ИП. Если в течение месяца никто из поставщиков, клиентов или бывших работников не заявит свои претензии, ИП ликвидируют.
Исключение из единого госреестра останавливает накопление долгов. Но, как и в случае с добровольным закрытием, все начисленные налоги и взносы переходят на физлицо.
Оставить ИП и ждать, что налоговая сама с ним разберётся, выгодно не всем и не всегда. В течение следующих трёх лет человек, чьё ИП закрыла налоговая, не сможет открыть новое. А ещё — неизвестно, когда инспекторы доберутся конкретно до вашего ИП. И всё это время размер долга будет расти, как снежный ком.
В течение следующих трёх лет человек, чьё ИП закрыла налоговая, не сможет открыть новое. А ещё — неизвестно, когда инспекторы доберутся конкретно до вашего ИП. И всё это время размер долга будет расти, как снежный ком.
Статья актуальна на
ИП без дохода: сколько платить налогов?
Часто бывает, что человек регистрирует ИП, но бизнес так и не начинает. Главное, что нужно знать — даже у неработающего предпринимателя копится долг по ежегодным страховым взносам. Другие долги на неактивном ИП бывают не всегда. Но мы побудем параноиками и расскажем, как проверить все возможные.
Чтобы остановить накопление долга, надо закрыть ИП. С конца 2020 года налоговая делает это сама. Но при таком исходе человеку запретят быть предпринимателем на три года.
Теперь обо всем по порядку.
У неработающего ИП всегда копится долг по страховым взносам
ИП без сотрудников платит страховые взносы за себя для получения пенсии по старости и медицинской помощи по полису.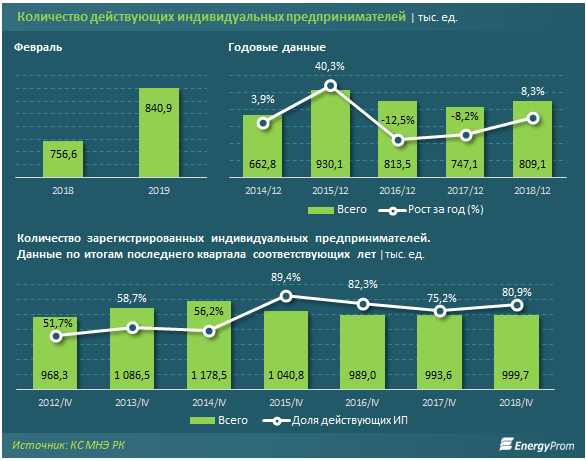 Взносы идут в Пенсионный фонд и Фонд медицинского страхования. Но платят их в одно окно — в налоговую инспекцию.
Взносы идут в Пенсионный фонд и Фонд медицинского страхования. Но платят их в одно окно — в налоговую инспекцию.
Размер взносов для ИП без сотрудников складывается из двух частей. Фиксированная — ее государство устанавливает на каждый год. И дополнительная — ее платят в размере 1 % от дохода, превышающего 300 000₽. У неработающего ИП набегает именно фиксированная часть взносов за каждый год. Но налоговая может взыскать долг только за последние три года — это ограничение из ст. 113 НК РФ.
Фиксированная часть взносов за 2022 год составляет 42 211 ₽. Из неё 34 445 ₽ идёт в пенсионку и 8766 ₽ в медстрах. Размеры взносов за предыдущие годы можно посмотреть здесь. Посчитать сумму за все года существования ИП можно в калькуляторе на сайте налоговой. Если ИП открылся не в начале года, размер взносов уменьшается пропорционально календарным дням. Если закрылся до конца года — тоже. Это следует из ст. 430 НК РФ.
Сроки оплаты взносов такие. Фиксированную часть платят каждый год до 31 декабря. Дополнительную часть — до 1 июля следующего года. Когда ИП закрывается, долги оплачивают в течение 15 дней после снятия с учёта в налоговой. Так сказано в ст. 432 НК РФ.
Дополнительную часть — до 1 июля следующего года. Когда ИП закрывается, долги оплачивают в течение 15 дней после снятия с учёта в налоговой. Так сказано в ст. 432 НК РФ.
За нарушение сроков уплаты взносов налоговая насчитывает пени. Размер — 1/300 ключевой ставки. Но больше тела долга пени насчитать не могут — ст. 75 НК РФ.
Калькулятор пени
Если ИП ничего не продавал, не отрывал счёт и не нанимал сотрудников, он всё равно платит страховые взносы. Предприниматели спрашивали, законно ли это, в Конституционном Суде. Там сказали так. Человек открывает ИП добровольно. Значит, у него есть необходимые деньги, образование и навыки, чтобы работать и выполнять налоговые обязательства — Определение № 164-О.
Однако всё же есть периоды, за которые страховые взносы можно не платить. Они прописаны в п. 7 ст. 430 НК РФ:
— служба в армии;
— уход за ребенком до 1,5 лет, но не больше 6 лет на всех детей;
— уход за инвалидом I группы, ребенком-инвалидом или за пожилым человеком старше 80 лет;
— период проживания с супругом в военной части или за границей в дипломатическом представительстве.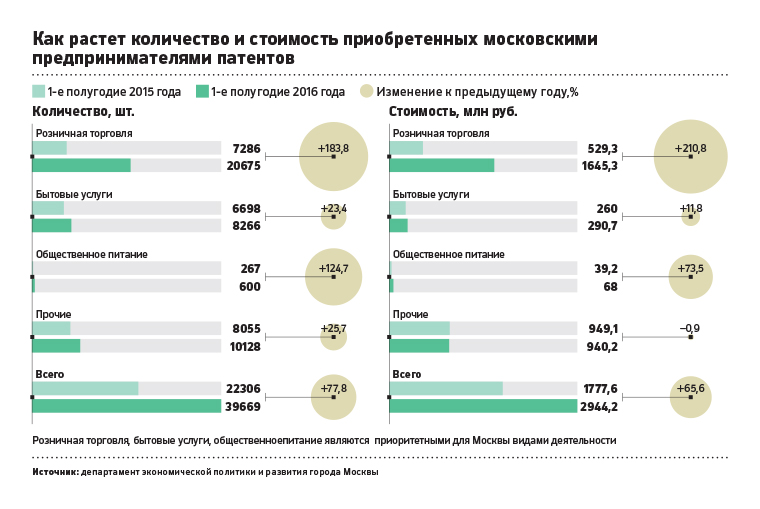 но в пределах 5 лет.
но в пределах 5 лет.
Чтобы налоговая отменила взносы, надо принести документы, которые подтверждают эти обстоятельства. Автоматом начисления не отменят.
Другие жизненные обстоятельства вряд ли избавят от долга. К примеру, суд отказался аннулировать взносы предпринимателю, который 6 лет сидел в тюрьме и не работал. Отказ объяснили тем, что даже из мест лишения свободы можно закрыть ИП через представителя, а не копить долг — дело № А34-10340/2019.
Если не было дохода, надо сдавать нулевую декларацию
Обычно предприниматель при регистрации выбирает спецрежим налогообложения — УСН или патент. Так делают, потому что на спецрежимах платят меньше налогов. Но если до заявления не дошли руки, ИП остается на общей системе налогообложения и платит НДФЛ, НДС и налог на имущество.
Единственный способ узнать свой налоговый режим — позвонить или сходить в налоговую.
Предприниматели на УСН и общей системе раз в год или квартал сдают в налоговую инспекцию декларацию, даже если не зарабатывали.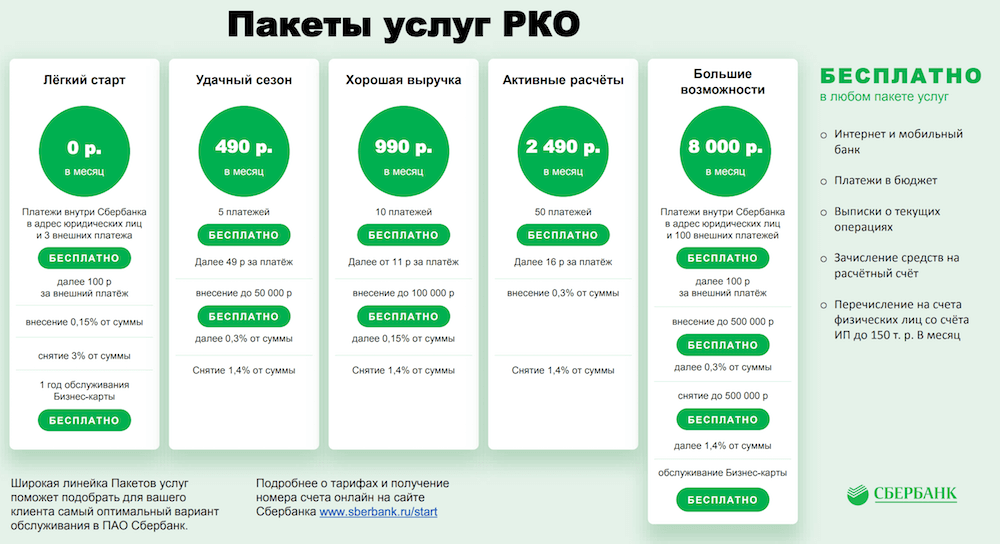 Так перед инспекторами подтверждают, что дохода не было и налог платить не надо. Декларацию без дохода называют нулевой. За каждую несданную декларацию налоговая штрафует на 1000 ₽ по ст. 119 НК РФ. Но штрафовать можно только за три последних года.
Так перед инспекторами подтверждают, что дохода не было и налог платить не надо. Декларацию без дохода называют нулевой. За каждую несданную декларацию налоговая штрафует на 1000 ₽ по ст. 119 НК РФ. Но штрафовать можно только за три последних года.
Штраф за несданные нулевые декларации плюсуется к долгу за неуплаченные страховые взносы и пени к ним.
🧮 Получается, что долг неработающего ИП перед налоговой — это сумма страховых взносов за последние три года + пени за просрочку уплаты + штрафы за декларации.
Как узнать про все долги ИП перед налоговой
Узнать полную и точную сумму долга можно, сходив лично в налоговую по месту жительства или через интернет-сервисы.
Посмотреть адрес своей налоговой и записаться на прием можно тут. На приёме у инспектора стоит запросить Справку о состоянии расчетов и Выписку операций по расчётам с бюджетом. По этим документам видно общую сумму долга и из-за каких платежей и штрафов она появилась.
Узнать про долги не выходя из дома и тут же погасить их можно в интернете:
— В разделе Налоговая задолженность через личный кабинет на Госуслугах;
— В личном кабинете ИП на сайте ФНС. Войти в кабинет можно через учетную запись с Госуслуг или с помощью ЭЦП, если она есть.
Войти в кабинет можно через учетную запись с Госуслуг или с помощью ЭЦП, если она есть.
Долги по налогам не просто болтаются в личном кабинете ИП. Сначала налоговая присылает требование об уплате, а потом пытается списать деньги со всех известных счетов и личных карт предпринимателя. Инспекторам так можно — ст. 76 НК РФ.
Если инспекторы не находят деньги на счетах, долг передают судебным приставам. Те могут прийти домой и забрать имущество. Найти свое дело можно в банке данных исполнительных производств.
Новым ИП — год Эльбы в подарок
Год онлайн-бухгалтерии на тарифе Премиум для ИП младше 3 месяцев
Попробовать бесплатно
Судебные споры с участием ИП
Иногда ситуация с бизнесом развивается так. Открыли ИП, немного поработали, но бизнес не пошел, и все бросили.
Даже если предприниматель совсем недолго продавал товары или арендовал помещение, у него могли остаться долги перед клиентами и контрагентами. Досудебные претензии, которые они отправляли почтой, легко пропустить. И возможно, на предпринимателя уже подали в суд.
Досудебные претензии, которые они отправляли почтой, легко пропустить. И возможно, на предпринимателя уже подали в суд.
Узнать о судебных делах с поставщиками, подрядчиками и арендодателями можно в картотеке арбитражных дел. Это база всех судебных споров между предпринимателями.
Если есть опасность, что к ИП остались претензии от клиентов-физлиц, стоит проверить базу судов общей юрисдикции в сервисе ГАС Правосудие.
Если обнаружили, что вы участник судебного дела, стоит сразу подключиться. Сходить в суд, сфотографировать в материалах исковое заявление и доказательства. Потом ходить на судебные заседания, спорить или попробовать пойти на мировое.
Как быть с ненужным ИП
Неработающее ИП стоит закрыть. Это остановит накопление долгов по взносам. Но сами долги никуда не денутся. Долги останутся висеть на физлице, и рано или поздно их придется гасить.
Если закрыть ИП самостоятельно, в будущем можно будет открыть новое. Закрыть ИП без сотрудников просто, быстро и почти бесплатно.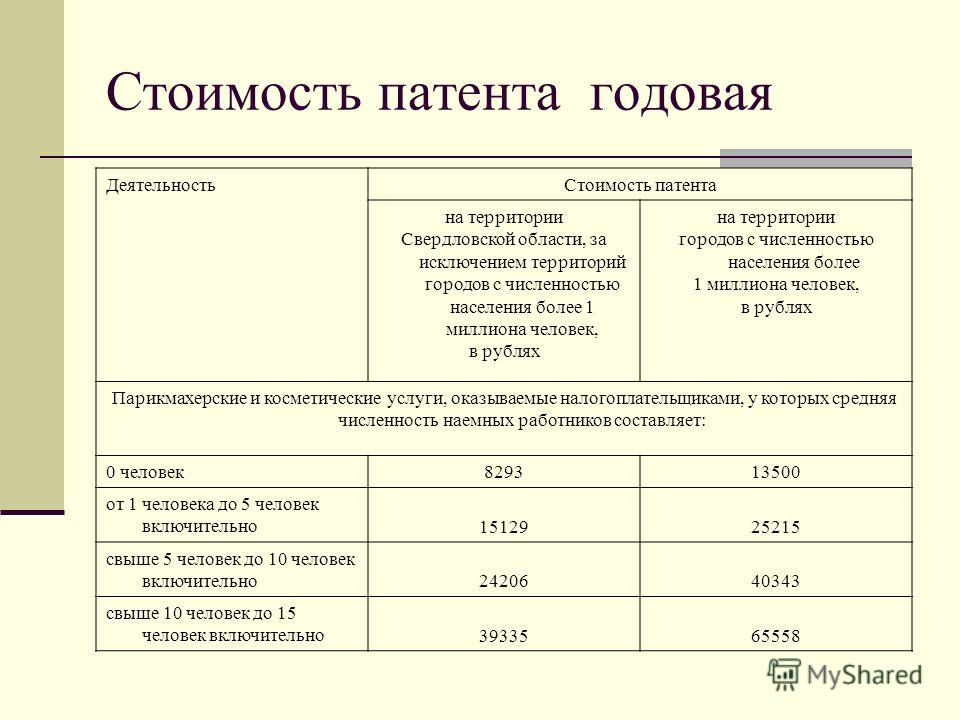 Посмотрите об этом нашу статью.
Посмотрите об этом нашу статью.
Продать или переоформить ИП на другого человека нельзя.
Неработающие ИП налоговая закрывает сама, но это не всегда хорошо
С конца 2020 года налоговая сама закрывает неработающие ИП. Если говорить юридическим языком — исключает предпринимателя из единого госреестра по ст. 22.4 Закона № 129-ФЗ.
Неработающими считаются ИП при соблюдении двух условий:
— они дольше 15 месяцев не сдавали расчёты и декларации или не продлевали патент,
— есть непогашенный долг по налогам или взносам.
До исключения налоговая пробует найти кредиторов ИП. Для этого в журнале «Вестник государственной регистрации» публикуют сообщение о предстоящем закрытии ИП. Если в течение месяца никто из поставщиков, клиентов или бывших работников не заявит свои претензии, ИП ликвидируют.
Исключение из единого госреестра останавливает накопление долгов. Но, как и в случае с добровольным закрытием, все начисленные налоги и взносы переходят на физлицо.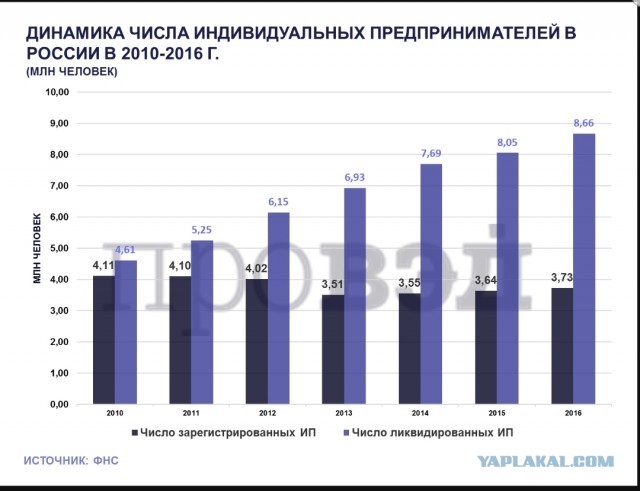
Оставить ИП и ждать, что налоговая сама с ним разберётся, выгодно не всем и не всегда. В течение следующих трёх лет человек, чьё ИП закрыла налоговая, не сможет открыть новое. А ещё — неизвестно, когда инспекторы доберутся конкретно до вашего ИП. И всё это время размер долга будет расти, как снежный ком.
Статья актуальна на
Быстрое определение гибридизации sp3, sp2 и sp
Структура и связывание
Быстрое определение гибридизации sp3, sp2 и sp быстро определить, является ли атом sp 3 , sp 2 или sp , не вдаваясь во все подробности того, как произошла гибридизация.К счастью, для этого есть короткий путь, и в этом посте я попытаюсь обобщить его в несколько отдельных шагов, которые вам нужно выполнить.
Допустим, вас попросили определить состояние гибридизации для пронумерованных атомов в следующей молекуле:
Первое, что вам нужно сделать, это определить количество групп, которые находятся на каждом атоме. Под группами мы подразумеваем либо атомы, либо неподеленные пары электронов. Это также известно как стерический номер (SN) .
Под группами мы подразумеваем либо атомы, либо неподеленные пары электронов. Это также известно как стерический номер (SN) .
Ниже приведены несколько примеров стерических чисел 2-4, которые в значительной степени являются тем, что вам нужно знать в органической химии:
Обратите внимание, что кратные связи не имеют значения, это атомы + неподеленные пары для любого типа связи.
Когда вы знаете, как определить стерическое число (это из теории ВСЕПР), вам просто нужно применить следующее соотношение:
Если стерическое число равно 4 , то оно равно sp 3
Если стерическое число равно 3 – sp 2
Если стерическое число равно 2 – sp
Итак, теперь давайте вернемся к гибридизации всех состояний атомов.
C1 – SN = 3 (три атома соединены), поэтому sp 2
C2 – SN = 3 (три атома соединены), поэтому
8
O4 – SN = 3 (1 атом + 2 неподеленные пары), следовательно, это sp 2
O5 – SN = 4 (2 атома + 2 неподеленные пары), поэтому это SP 3
C6 — SN = 4 (4 атома), поэтому он составляет SP 3
C7 — SN = 4 (4 ATOMS), поэтому он является. sp 3
sp 3
N8 – SN = 4 (3 атома + 1 неподеленная пара), поэтому sp 3
C9 – SN = 2 (2 атома), следовательно, sp
25 2
(2 атома), следовательно, это spВ дополнение к этому методу также очень полезно помнить некоторые признаки, связанные со структурой и гибридизацией. В общем, атом со всеми одинарными связями представляет собой sp 3 гибридизированный . Лучшим примером являются алканы. Все атомы углерода в алкане sp 3 гибридизованы с тетраэдрической геометрией.
Атомы углерода в алкенах и других атомах с двойной связью часто sp 2 гибридизованы и имеют тригонально-плоскую геометрию.
Тройная связь , с другой стороны, характерна для алкинов, где атомы углерода sp -гибридизированы .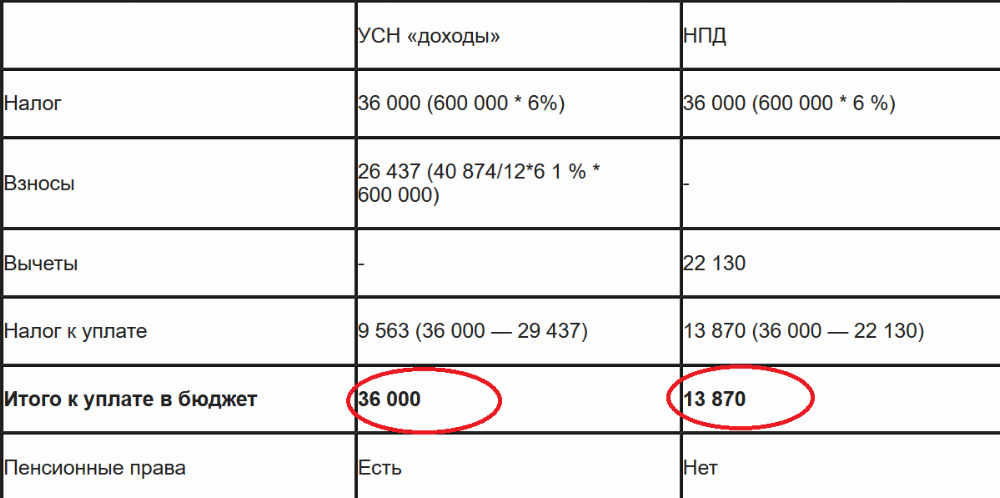
Есть несколько общих исключений из того, что мы обсуждали в отношении определения состояния гибридизации, и они в основном связаны с методом, в котором мы рассматриваем тип связи атома.
Например, в диоксиде углерода (CO 2 ) углерод имеет две двойные связи, но sp -гибридизирован.
А причина этого в том, что стерическое число углерода равно двум (с ним связаны только два атома кислорода) и для того, чтобы удержать два атома при 180 или , что является оптимальной геометрией, углерод должен использовать две идентичные орбитали. Это возможно только при гибридизации sp . Две другие 2p-орбитали используются для образования двойных связей с каждой стороны углерода.
Другим распространенным и очень важным примером являются карбокатионы.
Здесь углерод имеет только одинарные связи, и может показаться, что он sp 3 гибридизирован. Однако углерод в этих типах карбокатионы sp 2 гибридизированные . Опять же по той же причине, что его стерическое число равно 3 ( sp 2 – три одинаковые орбитали).
Опять же по той же причине, что его стерическое число равно 3 ( sp 2 – три одинаковые орбитали).
Единственным исключением со стерическим номером являются, например, амиды. Атом азота здесь имеет стерическое число 4 и ожидается sp 3 . Однако из-за резонансной делокализации неподеленной пары она взаимно преобразуется из sp 3 до sp 2 , поскольку это единственный способ иметь электроны на выровненной p-орбитали, которая может перекрываться и участвовать в стабилизации резонанса с электронами пи-связи двойной связи C=O.
В большинстве случаев вам не нужно беспокоиться об исключениях, если вы используете стерический номер.
Практика
1.
Определите состояние гибридизации каждого углерода и гетероатома (любого атома, кроме C и H) в следующих соединениях.
Подсказка: Не забудьте добавить недостающие неподеленные пары электронов, где это необходимо.
а)
ответ
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединившись к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех практических задач , включая более 20 часов видео по решению задач, викторин с несколькими вариантами ответов, головоломок, и мощного набора из Органическая химия 1 и 2 Краткое руководство .
b)
ответ
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединившись к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех практических задач , включая более 20 часов видео по решению задач, викторин с несколькими вариантами ответов, головоломок, и мощного набора из Органическая химия 1 и 2 Краткие учебные пособия .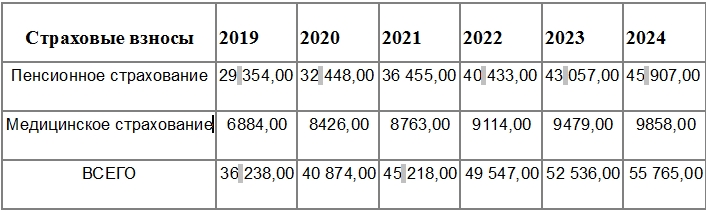
c)
ответ
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединившись к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех практических задач , включая более 20 часов видео по решению задач, викторин с несколькими вариантами ответов, головоломок, и мощного набора Органическая химия 1 и 2 Краткое руководство .
d)
ответ
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединившись к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех практических задач , включая более 20 часов видео по решению задач, викторин с несколькими вариантами ответов, головоломок, и мощного набора Органическая химия 1 и 2 Краткое руководство .
Решение
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединившись к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех практических задач , включая более 20 часов видео по решению задач, викторин с несколькими вариантами ответов, головоломок, и мощного набора Органическая химия 1 и 2 Краткое руководство .
2.
Для каждого отмеченного атома добавьте недостающие неподеленные пары электронов, чтобы определить стерическое число, электронную и молекулярную геометрию, приблизительные валентные углы и состояние гибридизации:
ответ
3.
ответ
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединившись к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех практических задач , включая более 20 часов видео по решению задач, викторин с несколькими вариантами ответов, головоломок, и мощного набора Органическая химия 1 и 2 Краткое руководство .
4.
ответ
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединившись к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех практических задач , включая более 20 часов видео по решению задач, викторин с несколькими вариантами ответов, головоломок, и мощного набора Органическая химия 1 и 2 Краткое руководство .
5.
ответ
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединившись к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех практических задач , включая более 20 часов видео по решению задач, викторин с несколькими вариантами ответов, головоломок, и мощного набора Органическая химия 1 и 2 Краткое руководство .
6.
ответ
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединившись к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех практических задач , включая более 20 часов видео по решению задач, викторин с несколькими вариантами ответов, головоломок, и мощного набора Органическая химия 1 и 2 Краткое руководство .
7.
ответ
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединившись к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех практических задач , включая более 20 часов видео по решению задач, викторин с несколькими вариантами ответов, головоломок, и мощного набора Органическая химия 1 и 2 Краткое руководство .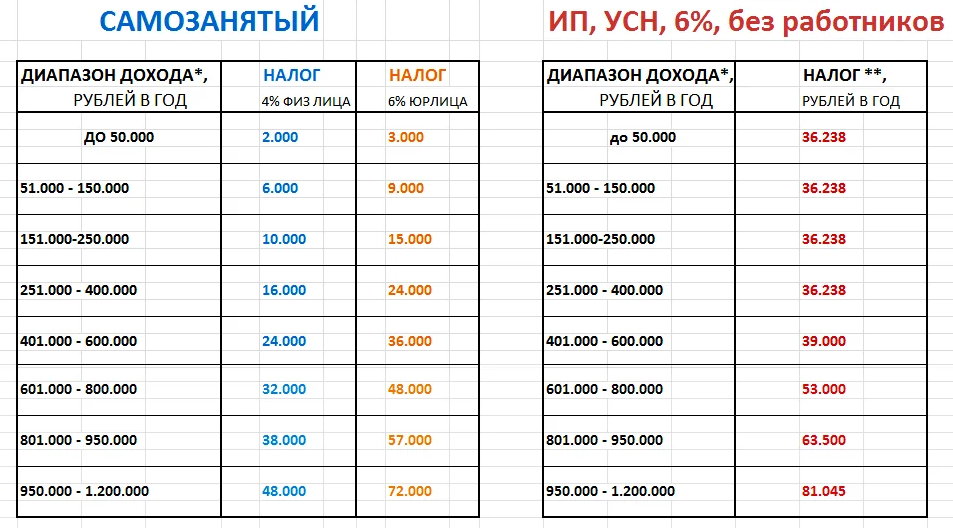
8.
ответ
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединившись к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех практических задач , включая более 20 часов видео по решению задач, викторин с несколькими вариантами ответов, головоломок, и мощного набора Органическая химия 1 и 2 Краткое руководство .
9.
ответ
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединившись к Chemistry Steps, вы получите мгновенный доступ к ответов и решений для всех практических задач , включая более 20 часов видеороликов по решению задач, викторин с несколькими вариантами ответов, головоломок, и мощный набор Органическая химия 1 и 2 сводных учебных пособий .
10.
ответ
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединившись к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех практических задач , включая более 20 часов видеороликов с решением задач, викторин с несколькими вариантами ответов, головоломок, и мощного набора Органическая химия 1 и 2 сводных учебных пособий .
11.
ответ
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединившись к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех Практические задачи , включая более 20 часов видеороликов по решению задач, викторин с несколькими вариантами ответов, головоломок, и мощный набор Органическая химия 1 и 2 Краткие учебные пособия .
12.
ответ
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединившись к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех практических задач , включая более 20 часов видеороликов по решению задач, викторин с несколькими вариантами ответов, головоломок, и мощный набор Органическая химия 1 и 2 сводных учебных пособий .
13.
ответ
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединившись к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех практических задач , включая более 20 часов видео по решению задач, Викторины с несколькими вариантами ответов, головоломки, и мощный набор Органическая химия 1 и 2 Краткие учебные пособия .
Решение
Этот контент предназначен только для зарегистрированных пользователей.
Нажмите здесь, чтобы зарегистрироваться!
Присоединившись к Chemistry Steps, вы получите мгновенный доступ к ответам и решениям для всех практических задач , включая более 20 часов видео по решению задач, викторин с несколькими вариантами ответов, головоломок, и мощный набор Органическая химия 1 и 2 Краткое руководство .
Гибридизация Sp3, Sp2 и Sp, геометрия и валентные углы запутаться, когда он снова появляется в молекулах и реакциях органической химии.
Когда я изучал общую химию, я просто запомнил таблицу геометрий и валентных углов и примерно понял, что происходит. Но только когда я начал думать об этом по-другому, как я объясню ниже, я наконец и по-настоящему понял.
В этой статье мы рассмотрим следующее:
- ПОЧЕМУ нужна гибридизация
- КАК происходит гибридизация
- Теория VSEPR
- Sp³ Гибридизация, угол связи и геометрия (включая видео)
- 06 Mole
- Sp² Гибридизация, угол связи и геометрия (включая видео)
- Гибридизация Sp, угол связи и геометрия
- Ярлык гибридизации
- Гибридизация Sp³d и sp³d² – обзор
Итак, давайте углубимся.
Помимо органической химии для студентов, эта тема имеет решающее значение для таких экзаменов, как MCAT, GAMSAT, DAT и других.
Зачем нужна гибридизация?
Молекулы повсюду! Как они формируются?
Проще говоря, молекулы состоят из связанных атомов,
Атомы связаны через различные типы связей,
Ковалентные связи являются самыми прочными и распространенными.
Чтобы создать ковалентную связь (видео), каждый участвующий атом должен иметь орбитальное «отверстие» (пустое пространство) для приема и взаимодействия с электронами другого атома.
Давайте совершим небольшой экскурс в обзор электронной конфигурации, сосредоточив внимание на валентных электронах, поскольку именно они участвуют в связи.
Чувствуете себя ржавым? Нажмите, чтобы просмотреть мои видео Electron Configuration + Shortcut .
Возьмите водород.
Имеет один электрон на 1s-орбитали. Для полного заполнения требуется еще один электрон.
Это оставляет отверстие для образования одной одинарной связи.
Отлично подходит для добавления еще одного водорода, но не очень подходит для построения большой сложной молекулы.
Теперь рассмотрим углерод.
Не случайно углерод является центральным атомом во всех макромолекулах нашего тела.
Белки, аминокислоты, нуклеиновые кислоты — все они имеют углерод в центре.
Почему? Потому что углерод способен образовывать 4 связи.
Это много по химическим стандартам!
И если любой из этих других атомов также является углеродом, у нас есть потенциал для создания гигантской молекулярной структуры, такой как АТФ, показанный ниже, источник энергии и генетический строительный материал внутри клеток.
Как это работает?
Обзор электронной конфигурации углерода показывает нам, что углерод имеет в общей сложности 6 электронов, и только 4 электрона в его валентной оболочке.
Но, подождите минутку!
Несмотря на наличие 4 валентных электронов,
Нет 4 пустых мест, ожидающих заполнения… ЕЩЕ !
2s-электроны в углероде уже спарены и поэтому не желают принимать новые входящие электроны в ковалентную связь.
Это оставляет нам:
- 2 p-орбитали, каждая с одним неспаренным электроном, способным образовывать ОДНУ связь
- Пустая p-орбиталь, не имеющая электрона для инициирования связи
При нынешней конфигурации углерод может 2 связи,
Используя свои ДВА неспаренных электрона,
Что не очень полезно, если мы пытаемся построить сложные макромолекулы.
Введите
Гибридизация .Если мы сможем найти способ переместить ОДИН из спаренных s-электронов на пустую p-орбиталь, мы получим что-то вроде этого.
Однако этого не может быть, потому что принцип Ауфбау гласит, что электроны должны заполнять атомные орбитали от самой низкой до самой высокой энергии. Об этом также рассказано в моих видео о конфигурации Electron .
Так что же нам делать, если мы не можем следовать принципу Ауфбау?
Введите гибридизацию!
Как происходит гибридизация?
Вот что я думаю о гибридизации.
Возьмем эту s-орбиталь, содержащую 2 электрона, и придадим ей частичный энергетический импульс. 906:33 В то же время мы лишаем немного p-орбитальной энергии.
Это дает нам 4 вырожденные орбитали, то есть орбитали с одинаковым количеством энергии.
В детстве мы с сестрой делили спальню. Нам это не понравилось, но это имело смысл, учитывая, что мы обе девочки и примерно одного возраста.
Когда мы переехали в квартиру с дополнительной спальней, у каждого из нас появилось свое пространство. Почему мы решили делить, если у нас была возможность иметь свои собственные комнаты?
Электроны точно так же. Теперь, когда у нас есть в общей сложности 4 вырожденных орбитали и 4 электрона, зачем нам заставлять их делить «комнату», если им это не нужно? 906:33 Вместо этого каждый электрон выйдет на свою собственную орбиту.
Количество электронов, которые движутся, и орбиталей, которые объединяются, зависит от типа гибридизации, которую мы хотим создать.
Итак, давайте разберемся.
Сегодня я сосредоточусь на sp³, sp² и sp-гибридизации, но поймите, что вы можете пойти еще дальше и создать такие орбитали, как sp³d и sp³d² (краткое упоминание в конце).
Гибридизация Sp³
Посмотрите видео ниже, где представлен краткий обзор гибридизации sp³ с примерами.
Вернемся к нашему примеру с углеродом.
Самая простая гибридизация достигается путем смешивания одной 2s-орбитали, содержащей 2 электрона, со всеми тремя p-орбиталями, также содержащими всего 2 электрона.
Теперь, когда у нас есть 4 вырожденных неспаренных электрона, каждый из них способен принять новый электрон от другого атома, чтобы создать в общей сложности 4 связи.
Но как мы называем эти новые «смешанные» орбитали?
Они больше не s, и они больше не p.
Вместо этого они где-то посередине.
Будучи вырожденной, каждая орбиталь имеет небольшой процент s и больший процент p.
Математический способ описать это смешивание — умножение.
Смешивая 1s и 3p, мы существенно умножили s x p x p x p.
Вспомните свой базовый урок математики.
Если у нас есть p, умноженное на себя (3 раза), это будет p x p x p
или p³.
Итак, КАЖДАЯ орбиталь является s x p³ или sp³ гибридной орбиталью,
Потому что они были получены из 1s и 3p-орбиталей.
Ch5 sp³ Гибридная геометрия
Возьмем простую молекулу метана, Ch5.
Каждая sp³ орбиталь в углероде принимает электрон от другого атома водорода, образуя в общей сложности 4 связи.
Но этот плоский чертеж работает только как простая структура Льюиса (видео) . Как только вы поймете, что такое гибридизация, от вас БУДУТ предсказывать точную форму (молекулярная и электронная геометрия, о которых мы вскоре поговорим), а также угол связи для каждого прикрепленного атома.
Давайте копнем глубже.
Электроны отрицательны, и, как вы помните,
Противоположности притягиваются (+ и -), а одинаковые заряды отталкиваются.
А эти отрицательные электроны на орбитах…
Ну, скажем так, они не любят друг друга.
Они настолько отталкивают друг друга, что существует целая теория, описывающая их поведение.
Теория VSEPR
VSEPR означает отталкивание электронных пар валентной оболочки.
Хотя в целом электроны не любят друг друга, им все же нравится иметь «партнера».
Итак, они существуют парами.
Это может быть одиночная электронная пара, сидящая на атоме, или связывающая электронная пара.
Например, см. воду ниже. Кислород имеет 2 неподеленные пары и 2 пары электронов, которые образуют связи между собой и водородом.
Единственным исключением является одинокий электрон-радикал, поэтому радикалы очень реактивны.
Теория VSEPR, которую часто называют теорией VES-per , говорит нам, что пара электронов будет отталкивать другие пары электронов как можно дальше от себя.
Если КАЖДАЯ электронная пара отталкивает другие как можно дальше, они найдут максимально возможный валентный угол, который они могут принять КАЖДОЙ.
Sp³ Угол связи и геометрия
Хотя в конечном итоге я хочу, чтобы вы могли рисовать и распознавать трехмерные молекулы без посторонней помощи, я настоятельно рекомендую вам сначала работать с набором моделей. Возможность видеть, трогать и манипулировать фигурами в реальном пространстве поможет вам лучше понять эти углы.
Посмотрите это видео, чтобы узнать все о Когда и как использовать набор моделей в органической химии .
Когда к центральному атому, такому как углерод, присоединены 4 эквивалентные группы (например, водород в нашем примере с метаном), теория VSEPR диктует, что они могут быть разделены максимум на 109,5 градусов. Это валентный угол sp³.
Название этой трехмерной формы — тетраэдр (существительное), что говорит нам о том, что молекула, подобная метану (Ch5), или, скорее, центральный углерод в метане, имеет тетраэдрическую форму.
Вы можете использовать термины «тетраэдрический» существительное или «тетраэдрический» прилагательное взаимозаменяемо.
Говорят, что углерод в метане имеет тетраэдрическую молекулярную геометрию И тетраэдрическую электронную геометрию.
Что сказать?
Молекулярная и электронная геометрия
Глядя на форму молекулы, мы можем посмотреть на форму, принятую атомами или форму, принятую электронами .
Каждая электронная пара в метане связана с другим атомом.
Но что, если у нас есть молекула, в которой меньше связей из-за наличия неподеленных электронных пар?
Молекулярная геометрия сообщает нам форму самой молекулы, обращая внимание только на атомы, игнорируя при этом неподеленные пары.
Электронная геометрия говорит нам о форме электронов вокруг центрального атома, независимо от того, существуют ли электроны в виде связи или неподеленной пары.
Давайте посмотрим поближе.
Nh4 Гибридизация и геометрия
Аммиак, или Nh4, имеет центральный атом азота.
Беглый обзор его электронной конфигурации показывает, что азот имеет 5 валентных электронов.
N = [He] 2s² 2p³
Следующий шаг несколько противоречит здравому смыслу, поскольку N, по-видимому, способен образовывать 3 связи со своими 3 p-орбитальными электронами. Однако неподеленные электронные пары ДОЛЖНЫ БЫТЬ той же энергии, что и сигма-связи, и поэтому они ВСЕ ЕЩЕ должны гибридизовать свои s- и p-орбитали.
Они будут гибридизованы в четыре sp³ орбитали, первая из которых содержит 2 (спаренных) электрона.
Остальные орбитали с неспаренными электронами могут свободно связываться с атомом водорода.
Хотя мы ожидаем, что аммиак будет иметь тетраэдрическую геометрию из-за его sp³-гибридизации, вот набор моделей, отображающий аммиак. Он кажется вам четырехгранным?
Не совсем так!
И тем не менее, согласно его Электронной Геометрии, он по-прежнему является тетраэдром.
Глядя на электронную геометрию, просто представьте неподеленную пару как электрон, связанный с электроном-партнером.
Однако его молекулярная геометрия, которую вы на самом деле видите в наборе, показывает только N и 3 H в заостренной трехногой форме, называемой Тригональная пирамида .
Тригональный , потому что он имеет 3 связанные группы.
Пирамидальный , потому что он образует пирамидальную структуру.
Треугольная пирамида имеет форму пирамиды с тремя опорами.
h3O Гибридизация и геометрия
Эта концепция молекулярной и электронной геометрии меняется еще больше, когда рассматриваемая молекула, хотя и все еще sp³, имеет 2 неподеленные пары и, следовательно, только 2 связи.
Молекула воды имеет центральный атом кислорода с 6 валентными электронами.
O = [He] 2s² 2p4
6 валентных электронов кислорода находятся на гибридных sp³ орбиталях, что дает нам 2 спаренных электрона и 2 свободных электрона.
Поскольку кислород в воде является sp³-гибридным, электронная геометрия по-прежнему выглядит как углерод (например, метан).
Но набор моделей показывает только 2 присоединенных атома H, что придает воде Bent Молекулярную геометрию.
Гибридизация Sp²
Что если я НЕ ищу 4 вырожденные орбитали?
Что, если я смогу обойтись только двумя или тремя гибридными орбиталями, окружающими центральный атом?
В видео ниже представлен краткий обзор sp² и гибридизации sp с примерами.
Все облигации, которые мы видели до сих пор, были сигма-облигациями или одинарными облигациями. Но вы можете вспомнить, что пи-связи имеют более высокую энергию И что они используют р-орбиталь, а не гибридную орбиталь.
Но вы можете вспомнить, что пи-связи имеют более высокую энергию И что они используют р-орбиталь, а не гибридную орбиталь.
Хотя менее распространены пустые орбитали (например, карбокатион), они также существуют с негибридными р-орбиталями.
Чтобы создать эту пи-связь или карбокатион, нам нужно сохранить р-орбиталь до гибридизации остальных. Взгляните на рисунок ниже.
На приведенном выше рисунке я сохранил одну из p-орбиталей, на которой был одинокий электрон, для использования в пи-связи.
Затем я смешал оставшиеся s-орбитали (два электрона) и 2 p-орбитали (только один электрон), чтобы получить 3 совершенно новых орбитали, содержащих в общей сложности 3 электрона.
Поскольку эти орбитали были созданы с помощью s, p и p, математический результат равен s x p x p,
или s x p², что мы можем просто назвать sp² .
Напоминание: двойная связь состоит из ДВУХ связей – одинарной или сигма-связи, соединенной со второй «двойной» или пи-связью. Сигма-связь ничем не отличается от связей, которые мы видели выше для CH 4 , NH 3 или даже H 2 9.0628 O. Мы просто добавляем пи-связь поверх сигмы, чтобы создать двойную связь (и вторую пи-связь, чтобы создать тройную связь).
Сигма-связь ничем не отличается от связей, которые мы видели выше для CH 4 , NH 3 или даже H 2 9.0628 O. Мы просто добавляем пи-связь поверх сигмы, чтобы создать двойную связь (и вторую пи-связь, чтобы создать тройную связь).
Пи-связь располагается частично над и частично под плоскостью молекулы как перекрытие негибридизованных р-орбиталей.
Угол связи Sp² и геометрия
Давайте посмотрим на центральный углерод в пропаноне или ацетоне, обычном полярном апротонном растворителе для последующих реакций замещения.
Как видите, центральный углерод дважды связан с кислородом и одинарно связан с 2 атомами углерода метильной группы. Это дает углероду всего 4 связи: 3 сигма и 1 пи .
Скорее всего, вы увидите это нарисованное как скелетную структуру для почти трехмерного представления следующим образом:
Согласно теории VSEPR, мы хотим, чтобы каждая из трех групп находилась как можно дальше от других. Если вы думаете о центральном углероде как о центре круга на 360°, вы получите 360/3 = 120°
Если вы думаете о центральном углероде как о центре круга на 360°, вы получите 360/3 = 120°
Техническое название этой формы — тригональная плоскость.
Trigonal говорит нам, что есть 3 группы.
Планар говорит нам, что он плоский.
Гибридная геометрия sp² представляет собой плоский треугольник.
Поскольку углерод в ацетоне не имеет неподеленных пар, его молекулярная геометрия (то, что вы видите на основе атомов) и его электронная геометрия (конфигурация электронов) являются тригонально-плоскими.
Что, если у нас ДЕЙСТВИТЕЛЬНО есть одинокие пары?
Как и в случае sp³, эти неподеленные пары также находятся на гибридных орбиталях, что делает кислород в ацетоне также sp²-гибридом.
Гибридизация и геометрия озона или O3
Озон — интересная молекула, поскольку благодаря резонансу вы можете нарисовать для нее несколько структур Льюиса. Давайте посмотрим на его основные содействующие структуры.
Если не учитывать формальные заряды (+) и (-), центральный атом кислорода имеет одну двойную связь (сигма и пи), одну одинарную связь (только сигма) и одну неподеленную пару. Все 2 сигма-связи и 1 неподеленная пара существуют на 3 вырожденных sp2-гибридных орбиталях.
В то время как тригональная плоская электронная геометрия похожа на ацетон, когда мы смотрим ТОЛЬКО на атомы, мы получаем Изогнутая форма для молекулярной геометрии.
Bh4 или BF3 Гибридизация и геометрия
Гибридизация Sp² не всегда должна включать пи-связь.
Возьмите молекулу типа Bh4 или BF3, и вы заметите, что центральный атом бора имеет всего 3 связи на 6 электронов. Это допустимое исключение из правила октетов.
3 связи требуют всего ТРИ вырожденных орбиталей. Смешивая s + p + p, мы все еще имеем одну оставшуюся пустую p-орбиталь.
В случае ацетона эта р-орбиталь использовалась для образования пи-связи. В случае бора пустая p-орбиталь просто сидит там пустой, ничего не делая, потенциально ожидая атаки, как вы позже увидите в реакции гидроборирования алкенов.
Я имею в виду… кто не хочет разбить пустую орбиту?
Sp Гибридизация Угол связи и геометрия
Просмотрите видео выше (начало раздела sp²), чтобы получить обзор sp² И sp гибридизации.
Атом может иметь до 2 пи-связей, иногда с одним и тем же атомом, например, тройной углерод в HCN (ниже), или 2 двойных связи с разными атомами, например, центральный углерод в CO2 (ниже).
В обоих примерах каждая пи-связь образуется из одного электрона на негибридизированной «сохраненной» р-орбитали следующим образом.
Чтобы получить sp-гибрид, мы просто смешиваем полную s-орбиталь с одной пустой p-орбиталью. Две содержащие электроны р-орбитали сохраняются для образования пи-связей.
Поскольку этот гибрид получается из s + p, математическое обозначение s x p или просто sp .
Согласно теории VSEPR, поскольку полученная молекула имеет только 2 связанные группы, группы будут располагаться как можно дальше друг от друга, то есть к противоположным концам молекулы.
Это дает нам Линейную форму как для электронной, так и для молекулярной геометрии sp с валентным углом 180°.
Гибридизация и геометрия HCN
До сих пор мы не обсуждали это, но всякий раз, когда у вас есть связанный атом водорода, его связь должна существовать на s-орбитали, потому что у водорода нет p-орбиталей, которые можно было бы использовать или гибридизовать.
Остальные атомы C и N в HCN связаны друг с другом тройными связями.
Обратите внимание, что хотя углерод также имеет одинарную связь с водородом, азот не имеет другой связи, а только неподеленную пару.
Оба этих атома находятся в состоянии sp-гибридизации.
Углерод имеет по 1 сигма-связи с H и N.
N имеет одну сигма-связь с C, а другая sp-гибридная орбиталь существует для неподеленной электронной пары.
И C, и N имеют по 2 р-орбитали, отведенных для тройной связи (2 пи-связи на вершине сигмы). Это делает HCN молекулой Linear с валентным углом 180° вокруг центрального атома углерода.
Гибридизация CO2
Углекислый газ, или CO2, представляет собой интересную и иногда сложную молекулу, потому что она IS sp гибридизована, но не из-за тройной связи.
Взгляните на центральный атом.
Углерод дважды связан с двумя разными атомами кислорода.
Каждое взаимодействие C-O состоит из одной сигма- и одной пи-связи.
Для сигма-связи требуется гибридная орбиталь, а для пи-связи требуется только р-орбиталь.
Это означает, что углероду в СО2 требуются 2 гибридные sp-орбитали, по одной на каждую сигма по отношению к кислороду, и 2 нетронутые p-орбитали, чтобы образовать одну пи-связь с обоими атомами кислорода.
ВОТ почему углерод sp-гибридизован, несмотря на отсутствие ожидаемой тройной связи, которую мы видели выше в примере с HCN.
Интересно, что если вы посмотрите на оба атома кислорода, вы заметите, что каждый из них содержит:
1 сигма-связь
1 пи-связь
2 неподеленные пары
Сигма-связи и неподеленные пары существуют на гибридных орбиталях. Поскольку нам нужны 3 гибридные орбитали, оба атома кислорода в CO2 являются sp²-гибридными.
Поскольку нам нужны 3 гибридные орбитали, оба атома кислорода в CO2 являются sp²-гибридными.
Ярлык гибридизации – считайте свой путь вверх
Вернувшись к общей химии, я помню, как корпел над двухстраничной таблицей, пытаясь запомнить, как идентифицировать каждый тип гибридизации. (Нам нужно было знать sp, sp², sp³, sp³d и sp³d².)
У вас нет времени на все это в органической химии.
Вот как определить гибридизацию путем быстрого подсчета групп :
1- Подсчитайте ГРУППЫ вокруг каждого рассматриваемого атома.
Каждая следующая группа считается ОДНОЙ группой:
- Одиночная электронная пара
- Односвязанный атом
- Двойной связанный атом
- Тройной связанный атом
Другими словами, группы включают одинарные, двойные связанные атомы или тройной) и одиночные пары.
2- Начните повторять орбитали по порядку, пока не достигнете того же числа.
Используя примеры, которые мы уже видели в этом руководстве:
Ch5 имеет 4 группы (4 H). Считайте 1, 2, 3, 4.
1: s
2: p¹
3: p²
4: p³
Просто считая вверх, вы наткнетесь на правильную гибридизацию – sp³.
Nh4 имеет 4 группы – 3 связанных атома H и 1 неподеленную пару.
1, 2, 3, 4 = s, p¹, p², p³ = sp³
Кислород в ацетоне имеет 3 группы – 1 двойной углерод и 2 неподеленные пары.
1, 2, 3 = s, p¹, p² = sp²
Центральный углерод в CO2 имеет 2 атома кислорода с двойной связью и больше ничего.
1, 2 = s, p¹ = sp
Щелкните правой кнопкой мыши таблицу ярлыков гибридизации ниже, чтобы загрузить/сохранить.
Sp³d и sp³d² гибридизация
Хотя sp³d и sp³d² гибридизация обычно не рассматриваются в органической химии и реже обсуждаются в целом, вы все равно видите их на своих экзаменах MCAT, GAMSAT, PCAT, DAT или аналогичных экзаменах.
Следуйте тому же трюку, описанному выше, чтобы увидеть, что гибридизация sp³d происходит в результате смешивания 5 орбиталей (1s, 3p и 1d) для получения 5 «групп», как показано в примере пентахлорида фосфора (PCl5) ниже.
Об авторе