Спецификация товара образец: Спецификация к международному контракту — образец и правила составления — Таможня Инфо
Спецификация к договору поставки. Образец, бланк для скачивания 2020 года
Как следует из самого названия, спецификация к договору поставки — это составная часть уже заключенного договора поставки.Файлы в .DOC:Бланк спецификации к договору поставкиОбразец спецификации к договору поставки
В силу этого спецификация не имеет самостоятельного характера и по своим юридическим характеристикам является опциональным (необязательным) приложением к основному договору.
Назначение документа
Вообще любая спецификация, как документ — это конкретизация неких условий, включая договорные. Необходимость в конкретизации может возникнуть по различным обстоятельствам, но в рамках договора поставки она объясняется чаще всего обширностью (масштабностью) объекта договора, то есть поставляемой продукции.
Таким образом, спецификация, по сути, включает в себя те положения договора, которые по тем или иным причинам не нашли в нем свое отражение.
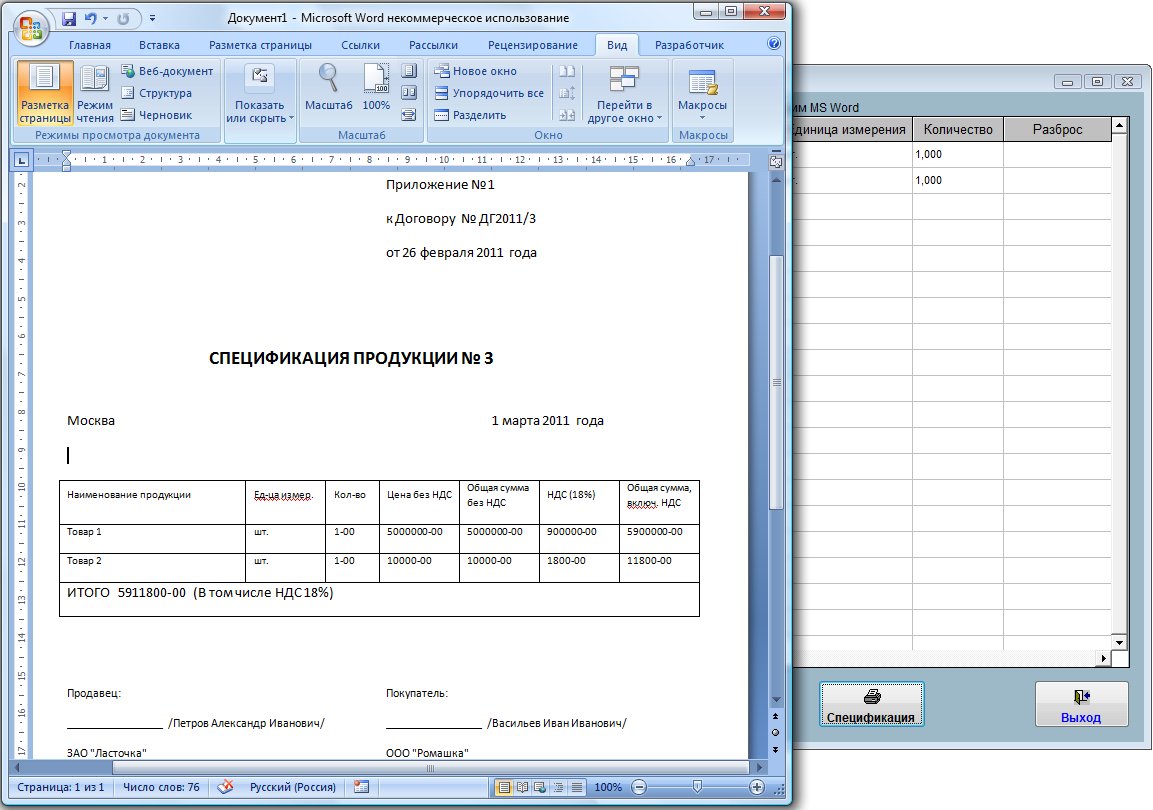
Как правило, спецификация к договору поставки конкретизирует поставляемую продукцию, то есть содержит в себе перечень поставляемых товаров или материалов, их количество по различным единицам измерения, ассортимент и т.
Целесообразность составления спецификации к договору поставки определяется самим характером поставки. Так, договор с длительным сроком действия, большим ассортиментом и количеством поставляемой продукции безусловно будет нуждаться с дополнительной спецификации или спецификациях на каждую поставляемую партию товара.
Составление
В первую очередь спецификация необходима поставщику. И именно на него возложена обязанность по составлению спецификации. Типового, обязательного к использованию образца спецификации не существует.
В рамках данной статьи наши пользователи могут скачать типовой шаблон спецификации к договору поставки и ознакомиться с образцом его заполнения.
С целью индивидуализации типового шаблона в отведенные для заполнения строки и столбцы потребуется внести следующие сведения:
- дату составления спецификации и ее номер в качестве приложения к основному договору;
- сведения об основном договоре, включая дату его составления и номер;
- наименования контрагентов;
- наименования продукции, поставляемой по договору;
- единицы измерения поставляемой продукции;
- общее количество поставки в одной партии;
- цену всей партии и цену за единицу продукции.
Спецификация подписывается руководителями предприятия поставщика и предприятия – покупателя. Оформляется спецификация в двух экземплярах, по одному для каждого из договорных контрагентов.
Оформленная и подписанная спецификация становится неотъемлемой частью основного договора и хранится совместно с ним.
Спецификация к договору поставки — образец, форма, оборудования, пример, товара, спецодежды
Договор поставки одно из наиболее популярных соглашений. Во избежание значительных утрат немаловажно составить верно, как договор, так и его составляющие. Одной из таковых выступает спецификация. Как ее сформировать?
В договоре о поставке товара подробно изложить получается не всю информацию, а только основные положения. Поэтому законодательно предусмотрены специальные приложения, например, спецификация.
Таковые являются неотделимой частью соглашения и обладают такой же юридической силой. Как составить спецификацию, прилагаемую к договору поставки?
Одним из дозволенных приложений к договору о поставке является спецификация. Надобно отметить, что без договора ни одно из приложений к нему само по себе не имеет законной силы.
Надобно отметить, что без договора ни одно из приложений к нему само по себе не имеет законной силы.
Обычно, создается спецификация в письменном виде и прикладывается ко всякому экземпляру договора. В то же время закон не воспрещает оформлять документ в ином виде.
Так спецификация может иметь форму:
- электронного письма;
- телеграфного сообщения;
- телефонных переговоров;
- факсимильного сообщения и т.д.
Основные понятия
Спецификация это документ, который дополняет основное соглашение, то есть заключенный договор о поставке. Спецификация отображает основные признаки товара, тары, продукции и т.д., какие передаются на основании договора.
В обязательном порядке в договоре поставки отображается ссылка на спецификацию. Спецификация это неотъемлемая часть договора, которая обладает такой же юридической силой.
В зависимости от вида передаваемой продукции и характеристики ее может меняться и вид спецификации.
Договор может предусматривать специальную форму или бланк спецификации.
Если участвующие стороны после согласования утвердят письменную форму документа, то таковой формат должен соблюдаться и в последующем.
Поставка товарной продукции в рамках договора может обладать как одноразовым характером, так и регулярным (многоразовым). Бланк данного соглашения можно скачать здесь.
Если имеют место многократные поставки, то спецификация может видоизменяться в зависимости от конъюнктуры или иных ситуаций.
Характеристики товара всякий раз оговариваются контрагентами заранее. Основополагающими характеристиками поставки являются:
- стоимость;
- номенклатура;
- количественный показатель;
- сроки для поставки;
- гарантии и т.д.
В случае надобности к спецификации прикладывают образцы поставляемого товара. В качестве примера образец спецификации к договору поставки можно скачать здесь.
Какова его роль
Основополагающей целью спецификации становится конкретизация соглашения на предмет уточнения количественных и стоимостных параметров поставляемых товаров.
Договор может заключаться на продолжительный срок, и основные его тезисы остаются неизменными. Такой договор поставки именуется рамочным, определяющим основные положения партнерства.
Что касается приложения к рамочному договору, то есть спецификации, то такая всякий раз составляется на основании конкретных условий поставки. При этом может меняться и форма ее, и содержание.
Если договор поставки стороны подписывают один раз, то спецификация подписывается всякий раз при поставке новой партии товаров. Но если оговоренная форма спецификации меняется, это должно предварительно согласовываться контрагентами.
Действующие нормативы
Ст.429.1 ГК РФ позволяет заключать рамочный договор, то есть такой договор, в каком содержатся основные условия, корректируемые в дальнейшем прочими документами.
Такая форма взаимоотношений представляется удобной при долговременном сотрудничестве. Как документ, конкретизирующий основные договорные условия, законодатель предлагает использовать спецификацию к договору поставки.
Согласно законодательному определению спецификация это часть основного рамочного договора. В непреложном порядке она предусматривает указание состава партии поставки и иных значимых условий конкретной поставки.
Конечно, договор может предусматривать согласование предмета в счетах-фактурах и товарных накладных.
Но эти бумаги передаются в момент выполнения обязательств по определенной партии, и контрагенты лишены возможности переговоров. При этом покупатель получает товар «как есть», а продавец ожидает уплаты в «разумный срок».
Конкретизировать спецификацией рекомендовано условия договоров поставки когда:
| Контрагенты представлены крупными компаниями с разветвленной сетью | Когда грузополучатель и грузоотправитель значительно отдалены друг от друга |
| Особое значение имеют характеристики товара | Но описать их одной фразой крайне затруднительно |
| Цена товара | Зависит от рынка и постоянно меняется |
Утвержденной законодательно формы спецификации не предусмотрено. Потому целесообразно составлять документ в произвольной форме, размещая его на листе формата А4.
Потому целесообразно составлять документ в произвольной форме, размещая его на листе формата А4.
Рациональным считается указание в спецификации таких сведений:
- наименования контрагентов, точные реквизиты и данные правомочных представителей;
- дата создания формы и временной период поставки;
- технические характеристики поставляемого предмета;
- прилагаемые документы и иные значимые условия.
На момент поставки и передачи заполненного бланка спецификации представители сторон подписывают сей документ, и скрепляют его печатями.
Если от лица сторон выступают представители, то к спецификации необходимо прикладывать доверенности в оригинале.
В большинстве случае используют табличную часть, в которой удобно отображать существенные характеристики поставляемых товаров.
Количество граф таблицы определяется индивидуально, в зависимости от конкретного объекта. Обыкновенно в таблице отображается:
- порядковый номер товара;
- полное название;
- измерительная единица;
- ГОСТ;
- стоимость одной единицы;
- совокупная стоимость (с НДС и без НДС).

Форма соглашения
Форма спецификации отсутствует, поскольку таковая является инструментом идентификации и конкретизации конкретного товара.
Какой указывают предмет договора поставки смотрите в статье: договор поставки.Про ответственность продавца по договору розничной купли-продажи, читайте здесь.
А так как характеристики товара могут меняться, то и предусмотреть единую форму не представляется возможным. Стороны могут утвердить определенную форму и при необходимости добавлять в нее необходимые данные.
Независимо от конфигурации спецификации обязательно следовать главным правилам заполнения:
| Обязательно наличие ссылки в основном договоре | Что к договору прилагается спецификация. Выставляют надлежащую отметку в разделе договора, касающемся порядка поставки |
| Заполняется спецификация на отдельном листе | И подписывается до получения товара |
| Указанный в спецификации товар | Обязательно согласуется сторонами |
| Обязательно спецификация подписывается обеими сторонами | Иначе юридической силы документ иметь не будет |
| Составляют спецификацию в двух экземплярах | По одному для каждой стороны |
Относительно формы спецификации можно отметить и то, что она может выступать:
| Неотъемлемой частью соглашения | Прилагаемой к договору поставки |
| Частью расчетных документов | Прилагаемой к счету |
| Отгрузочной товарно-сопроводительной спецификацией | На определенную партию поставляемого товара |
Когда требуется изменить утвержденную форму спецификации, следует учитывать, что документ этот часть договора, обладающая юридической силой.
Следовательно, изменять ее надобно в том же порядке, что и договор поставки. При изменении спецификации стороны согласовывают новую форму и оформляют соглашение в письменном виде.
В данном соглашении указывается:
- содержание новой договоренности;
- дата старой спецификации;
- номер основного договора;
- суть новой формы.
При утверждении новой формы спецификации применение старого формата упраздняется. В настоящее время все большее распространение получает торговля онлайн.
В таком случае спецификация может формироваться в электронном формате. При этом доказательством выполнения условий договора становится распечатанный электронный документ и факт оплаты товара.
В самом договоре указывается, что спецификация составляется в электронном виде. Причем обязательно в тексте договора следует отобразить адреса электронной почты, как поставщика, так и покупателя.
Нюансы в зависимости от объекта
Основным предназначением спецификации является согласование предмета договора. То есть спецификация содержит в себе все существенные характеристики конкретного объекта.
То есть спецификация содержит в себе все существенные характеристики конкретного объекта.
При этом основные характеристики согласуются при заключении самого договора, например, название товара и его общее количество. В спецификации детально оговариваются характеристики конкретной поставки.
Так может указываться количество конкретного товара, описание и параметры, используемая тара, стоимость дополнительных услуг. Принятие товара осуществляется строго в соответствии со спецификацией.
Строительных материалов
Договор поставки строительных материалов весьма схож с договором купли-продажи. Единственное отличие это продажа товара для целей реализации бизнеса и представление сторон юридическими лицами и ИП.
Отличительная черта договора поставки строительных материалов в том, что стороны четко оговаривают:
- количество стройматериалов;
- ассортимент;
- качество;
- срок поставки;
- срок и порядок оплаты;
- адрес поставки и прочие условия.

Все существенные данные и оговариваются в спецификации, которая становится неотъемлемой частью договора. Также можно ознакомиться со следующими документами:
- проект договора на поставку строительных материалов;
- измененная спецификация.
Оборудования
Спецификация поставки оборудования это документ, определяющий состав технологического, санитарно-технического, электротехнического и иного оборудования, предусмотренного надлежащим основным комплектом рабочих чертежей.
Такой документ часто именуется технической спецификацией. В ней отображаются характеристики и технические нюансы, присущие конкретному оборудованию.
Предприятие-получатель на основании спецификации формирует технический пакет документов при изготовлении сложных конструкций.
Для сборных чертежей спецификация полезна тем, что в ней отражено полное описание отдельных деталей, узлов и составных фрагментов.
В спецификацию оборудования не включают виды изделий массового производства (винты, болты, соединительные изделия), учтенные в стоимости монтажа и поставляемые на основании норма расходов материалов.
Указывается в документе:
| Название оборудования и технические характеристики | В соответствии с ГОСТами, иными стандартами, техническими условиями и прочей технической документацией |
| Тип и марка оборудования | — |
| Код оборудования | По классификатору с/х и промышленной продукции |
| Наименование | Завода-изготовителя |
| Единица измерения | — |
| Количество оборудования | — |
| Масса одной единицы | — |
Составляют спецификацию оборудования в соответствии с ГОСТом 21.110-2013.
Спецификации оборудования присваивают обозначение, состоящее из обозначения соответственного комплекта рабочих чертежей с указанием кода «СО». Например, «1234-10-ТХ.СО».
Например, «1234-10-ТХ.СО».
Как пример, договор поставки оборудования со спецификацией:
Спецодежды
Спецодежда является одним из элементов средств индивидуальной защиты (СИЗ). В РФ классификация СЗ установлена ГОСТом 12.4.011-89.
В зависимости от назначения средства защиты делятся на одиннадцать классов, которые разделяются на типы. Согласно ст.215 ТК РФ вся спецодежда подлежит обязательной сертификации.
Для закупки спецодежды предприятия заключают договор с производителем, оговаривая наименование СИЗ, модели, размеры и прочие нюансы.
При поставке товара к нему прилагается спецификация, в которой подробно описывается каждое отдельное наименование поставленного товара с указанием всех значимых характеристик.
Пример спецификации
Вид спецификации зависит от особенностей каждого отдельного случая. Оформляется спецификация на основе документа, каким оформляется поставка.
Заполняет документ поставщик. Если договор заключен на длительный срок, желательно ежегодно уточнять или согласовывать форму спецификации.
Если договор заключен на длительный срок, желательно ежегодно уточнять или согласовывать форму спецификации.
Содержание спецификации зависимо от конкретных обстоятельств, но некоторые данные указываются обязательно, в частности:
- номер документа;
- наименование сторон;
- название товара;
- единица измерения;
- количество;
- цена и общая стоимость;
- срок поставки;
- подписи сторон.
При использовании альтернативных форм необходимо учитывать, что при возникновении претензий у сторон по выполнению договора поставки, придется доказывать предоставление спецификации.
Нужно иметь подтверждение, что контрагенту была передана информация, изложенная в спецификации, и он ее действительно получил.
Потому по возможности требуется дублирование информации посредством письменной корреспонденции.
Внимание!
- В связи с частыми изменениями в законодательстве информация порой устаревает быстрее, чем мы успеваем ее обновлять на сайте.

- Все случаи очень индивидуальны и зависят от множества факторов. Базовая информация не гарантирует решение именно Ваших проблем.
Поэтому для вас круглосуточно работают БЕСПЛАТНЫЕ эксперты-консультанты!
- Задайте вопрос через форму (внизу), либо через онлайн-чат
- Позвоните на горячую линию:
ЗАЯВКИ И ЗВОНКИ ПРИНИМАЮТСЯ КРУГЛОСУТОЧНО и БЕЗ ВЫХОДНЫХ ДНЕЙ.
Спецификация оборудования и материалов в Excel
Представляю вашему вниманию шаблон спецификации оборудования, изделий и материалов выполненный в программе Microsoft Excel. Данный шаблон работает во всех версиях программ Microsoft Excel.
Данный шаблон спецификации выполнен для листа формата А4. Графы в спецификации заполнены в соответствии с формой 1 — ГОСТ 21.110-2013 (действующий). Шрифт в шаблоне принимается GOST type A. Если вам данный шрифт не подходит, его можно изменить как на листе «СВОДНАЯ», так и на листе «Спецификация».
Использовать спецификацию нужно в следующем порядке:
1. Все технические характеристики оборудования, изделий и материалов вы указываете ТОЛЬКО на листе «СВОДНАЯ». На этом же листе, вы можете копировать, вставлять, удалять, редактировать спецификацию как вам угодно. Все данные которые вы указываете на данном листе, также отображаются на листе «Спецификация».
2. На листе «Спецификация» вы уже получаете готовую спецификацию заполненную по форме 1 — ГОСТ 21.110-2013 со штампами. На данном листе вам осталось только заполнить штампы.
3. Печать спецификации выполняется с листа «Спецификация». Для того что бы распечатать спецификацию, вам нужно выбрать область печати. Для этого перейдите на последний лист спецификации и передвиньте границу синей рамки, используя ползунок, к нижней границе листа. При этом активные листы для печати будут выделены белым цветом, а неактивные листы – серым цветом.
Всего наилучшего! До новых встреч на сайте Raschet. info.
info.
Поделиться в социальных сетях
Благодарность:
Если вы нашли ответ на свой вопрос и у вас есть желание отблагодарить автора статьи за его труд, можете воспользоваться платформой для перевода средств «WebMoney Funding».
Данный проект поддерживается и развивается исключительно на средства от добровольных пожертвований.
Проявив лояльность к сайту, Вы можете перечислить любую сумму денег, тем самым вы поможете улучшить данный сайт, повысить регулярность появления новых интересных статей и оплатить регулярные расходы, такие как: оплата хостинга, доменного имени, SSL-сертификата, зарплата нашим авторам.
Спецификация ТОРГ-10 (бланк и образец). Как правильно заполнить форму ТОРГ-10
Данная форма составляется в том случае, когда отфактурованная партия товара упаковывается в ящики, бочки и т.п. В спецификации перечисляется каждое отдельное место с товаром и проставляется его масса. Масса тары проставляется отдельно. Тара, отпущенная с товаром по этой спецификации, указывается на оборотной стороне бланка. Упакованный товар передается экспедиции, агенту (экспедитору, водителю) по количеству мест или массе брутто под расписку на бланке спецификации.
Упакованный товар передается экспедиции, агенту (экспедитору, водителю) по количеству мест или массе брутто под расписку на бланке спецификации.
Унифицированная форма № ТОРГ-10 утверждена постановлением Госкомстата России от 25.12.98 г. № 132.
Читайте также Управленческий учет на предприятии >>
Скачать бланк ТОРГ-10 (Excel)
Узнайте, как автоматически заполнять первичные документы >>
(Выписывайте документы без ошибок и в 2 раза быстрее за счет автоматического заполнения документов в программе Бизнес.Ру)
Посмотреть образец заполнения: стр.1 стр.2
Посмотреть полный каталог бланков
Как правильно заполнить спецификацию ТОРГ-10
Спецификация представляет собой список товаров, подготовленных к отправке с целью дальнейшей продажи. В ней в обязательном порядке указывается следующая информация: наименование, масса и количество товара, вид упаковки и вес тары. Также указывается номер упаковочного ярлыка.
Также указывается номер упаковочного ярлыка.
Масса упаковочной тары указывается отдельно. На документе в обязательном порядке должен присутствовать полный юридический адрес организации-продавца. Форма ТОРГ-10 используется тогда, когда подготовленная партия товара уже готова к продаже и расфасовывается по таре.
Документ заполняется материально ответственным лицом в двойном экземпляре. Обычно за заполнение документа отвечает кладовщик или иное лицо, ответственное за материальные ценности. На нем в обязательном порядке проставляется печать организации.
Один из заполненных экземпляров передается в бухгалтерию. Второй экземпляр вместе со счетом-фактурой отправляется к покупателю. В бухгалтерии документ регистрируется в соответствии с действующим законодательством.
Каждый отдельно взятый товар регистрируется в спецификации в отдельной строке. При этом указывается соответствующая данному товару масса брутто. Если товар отпускается вместе с тарой, то на обратной стороне бланка указывается вид тары и товара. Также указывается каждое отдельно взятое место с товаром.
Также указывается каждое отдельно взятое место с товаром.
Все данные, которые вносятся в форму, должны отвечать действительности и отражать реальную ситуацию. Это необходимо по той простой причине, что спецификация представляет собой документ бухгалтерской отчетности. Заполняется документ черными или синими чернилами. Все данные указываются не только цифрами, но и прописью.
Это обязательно нужно учесть при оформлении данного документа. Не допускаются исправления, и если при оформлении были указаны неверные данные – документ следует переписать, а не исправлять. В противном случае спецификацию нельзя считать действительной.
После того как форма надлежащим образом заполнена – товар передается водителю или экспедитору под роспись в соответствующей графе бланка.
Читайте также Прогнозирование объемов продаж >>
Как автоматизировать работу с документами и не заполнять бланки вручную
Автоматическое заполнение бланков документов. Сэкономьте свое время.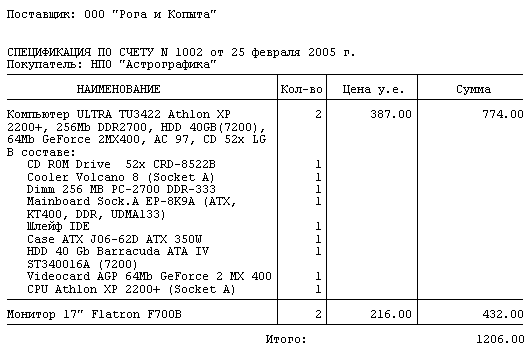 Избавьтесь от ошибок.
Избавьтесь от ошибок.
Подключитесь к КЛАСС365 и пользуйтесь полным спектром возможностей:
- Автоматически заполнять актуальные типовые формы документов
- Печатать документы с изображением подписи и печати
- Создавать фирменные бланки с вашим логотипом и реквизитами
- Составлять лучшие коммерческие предложения (в том числе по собственным шаблонам)
- Выгружать документы в форматах Excel, PDF, CSV
- Рассылать документы по email прямо из системы
- Вести учет торговли и склад онлайн
С КЛАСС365 вы сможете не только автоматически готовить документы. КЛАСС365 позволяет управлять целой компанией в одной системе, с любого устройства, подключенного к интернету. Легко организовать эффективную работу с клиентами, партнерами и персоналом, вести торговый, складской и финансовый учет. Бесплатная программа для учета товара КЛАСС365 автоматизирует всё предприятие.
Документ функциональной спецификации: что это такое и как его создать?
При обращении в компанию, занимающуюся разработкой программного обеспечения, имея в виду проект, полезно предоставить документ, в котором перечислены все требования. Команды разработчиков используют его для предварительной оценки проекта и, после его запуска, для углубленного анализа потребностей.
Команды разработчиков используют его для предварительной оценки проекта и, после его запуска, для углубленного анализа потребностей.
Один из документов, который вам необходимо включить, — это функциональная спецификация.
Прочтите эту статью, чтобы узнать, зачем вам нужен документ функциональной спецификации, что это такое, для кого он нужен и как написать такой документ, который гарантирует успех вашего проекта.
Что такое функциональная спецификация?
Функциональная спецификация работает как — план, который помогает команде разработчиков понять, как приложение будет работать . Он шаг за шагом описывает пользовательский опыт.
Функциональная спецификация в основном сообщает разработчикам, какие функции им необходимо создать и почему. Это также помогает всем заинтересованным сторонам, участвующим в процессе, проработать их часто расходящиеся мнения, сосредоточив внимание на ряде целей.
Зачем писать функциональную спецификацию?
Проще создать продукт с помощью слов, чем кода. Чтобы придумать альтернативы для пересмотра и улучшения записанного дизайна, уходит несколько минут. То же самое может занять недели, когда дело доходит до кодирования итеративного дизайна.
Чтобы придумать альтернативы для пересмотра и улучшения записанного дизайна, уходит несколько минут. То же самое может занять недели, когда дело доходит до кодирования итеративного дизайна.
Функциональная спецификация гарантирует, что разработчики работают над правильными функциями с первого дня, и значительно снижает риск неудачи проекта.
Для кого это?
Функциональная спецификация предназначена для всех участников проекта. Он сообщает разработчикам, какие функции им необходимо создать и как, но рекомендуется поделиться им со всей командой для большей прозрачности и совместной работы.
Написание функциональной спецификации
Теперь, когда вы знаете, что такое функциональная спецификация и почему ее писать — это хорошая идея, вот несколько советов, которые помогут вам начать работу.
Спецификация — это текстовый документ, в котором указаны заинтересованные стороны, его собственная история и потенциальные предыдущие утверждения. Кроме того, функциональная спецификация должна включать:
- Объем проекта — цели, результаты, характеристики, задачи, затраты и сроки проекта.

- Риски и допущения — все факторы, которые могут повлиять на функциональный дизайн продукта.
Обзор продукта — здесь вы объясняете, как ваше приложение решает конкретную проблему вашей целевой аудитории (отображается, например, на картах сайта, потоках экранов, каркасах) - Сценарии использования — здесь вы помещаете функциональные требования в контекст действия пользователя. Этот момент важен, потому что вы будете показывать, что происходит в приложении с точки зрения пользователя.
- Требования — критические характеристики вашего продукта, которые отвечают на вопрос: что делает ваш продукт?
- Конфигурация — шаги, необходимые для настройки продукта (например, настройка учетной записи)
- Нефункциональные требования — в вашем документе также могут быть перечислены полезные функции, которые не являются основными ваш продукт.
- Отчеты об ошибках — объясните, как ваш продукт будет обрабатывать ошибки или исключения.
 Какие сообщения должны отображаться и какие параметры должны быть представлены пользователям в пользовательском интерфейсе?
Какие сообщения должны отображаться и какие параметры должны быть представлены пользователям в пользовательском интерфейсе?
Обратите внимание, что ваша спецификация не обязательно должна включать каждый из этих пунктов. В зависимости от вашего проекта и команды, документ функциональной спецификации может принимать разные формы.
Напишите подробные варианты использования
Давайте рассмотрим этот момент подробно. Теоретически мы все знаем, что такое варианты использования. Вариант использования описывает поведение системы, когда пользователь выполняет действие.Но что должен включать вариант использования?
Вот несколько важных элементов, которые должен иметь каждый вариант использования, чтобы предоставить разработчикам максимальный контекст для разработки функций:
- Имя — это верно, вам нужно придумать отдельное имя для каждого варианта использования. Вот как вы сможете ориентироваться в вариантах использования, когда напишете многие из них.

- Описание — для каждого варианта использования необходимо подробное описание, в котором вы указываете несколько вещей:
- Предварительные условия — каково состояние вашего приложения в начале варианта использования?
- Действующие лица — кто пользователи вовлечены в прецедент и какую проблему они хотят решить?
- Базовый поток — пошаговый процесс в вашем приложении.
- Альтернативный поток — альтернативный поток при условии, что пользователь выбирает вариант.
- Поток исключений — другой тип потока, который следует за исключением из основного потока, описанного в вашем варианте использования.
- Условия публикации — состояние вашего приложения после того, как пользователь выполнил действие.
Вовлекайте всю команду
Разумно создать функциональную спецификацию вместе со всеми критически важными участниками проекта. Их вклад поможет вам решить, какие функции являются основными и должны быть разработаны в первую очередь, как будет выглядеть пользовательский интерфейс и как приложение будет обрабатывать ошибки. Чем больше людей будут его просматривать, тем лучше.
Чем больше людей будут его просматривать, тем лучше.
Имея этот документ в руках, вы можете быть уверены, что разработчики проделают большую работу при создании вашего продукта.
Вы ищете команду опытных разработчиков программного обеспечения? Свяжись с нами; мы имеем большой опыт реализации различных ИТ-проектов.
Образец спецификации VERIFI® | Ресурс
РАЗДЕЛ 03300 — ЗАЛИВНОЙ БЕТОН
Дозированное добавление воды в пути
Примечание к спецификатору: ASTM C94 / C94M был пересмотрен в 2013 году, чтобы разрешить добавление воды во время транспортировки для грузовиков, оборудованных автоматическими системами управления осадками и водными ресурсами.Проверьте свою спецификацию, чтобы убедиться, что она не запрещает добавление воды в пути. Добавьте следующий текст.
Добавки воды во время транспортировки должны производиться в соответствии с ASTM C94 / C94M.
Автоматизированный контроль качества и обеспечение качества
Примечание к спецификатору: Следующий текст определяет минимальные требования к автоматизированной системе управления просадками для обеспечения постоянного качества бетона.
ЧАСТЬ 1 — ОБЩИЕ ПОЛОЖЕНИЯ
1.X Контроль качества подрядчиком
- Автоматизированная система управления просадками. Автобетоносмесители должны быть оснащены системой управления просадками VERIFI® (GCP Applied Technologies, www.gcpat.com, 62 Whittemore Ave Cambridge, MA 02140) или эквивалентной системой, способной выполнять следующие функции:
- Отслеживайте осадку бетона с точностью +/- 1 дюйм (25 мм). Оборудование должно получить одно или несколько физических измерений автобетоносмесителя, относящихся к просадке бетона, и обеспечить индикацию просадки на основе заранее установленных корреляций.Оборудование должно иметь точность от 50% до 100% объема смесительного барабана. По запросу поставщик бетона должен предоставить данные не старше 24 месяцев, подтверждающие точность калибровки для каждого типа грузовика.
- Измеритель воды, добавленной в грузовик с точностью +/- 3% от добавленного количества или +/- 1 кварта (1 литр), в зависимости от того, что больше. По запросу поставщик бетона должен предоставить данные не старше 12 месяцев, подтверждающие точность калибровки.
- Измерительная добавка добавлена в грузовик с точностью +/- 3% от добавленного количества или +/- 1 кварта (1 литр), в зависимости от того, что больше.По запросу поставщик бетона должен предоставить данные не старше 24 месяцев, подтверждающие точность калибровки.
- Контролируйте температуру бетона с точностью до +/- 2 ° F (1 ° C). По запросу поставщик бетона должен предоставить данные не старше 24 месяцев, подтверждающие точность калибровки.
- Выполните автоматическое добавление воды, примеси или того и другого для достижения заданной осадки.
- Прекратите добавление воды при достижении максимального содержания воды для смеси.
- По запросу на строительной площадке предоставить инспектору с помощью электронных средств или визуального отображения следующие данные: осадка бетона, температура бетона, добавленная вода, добавленная добавка, возраст, общее количество оборотов, общее количество оборотов при скорости перемешивания с момента последнего добавления воды.
- Предоставить инженеру следующие электронные средства: осадка бетона, температура бетона, добавленная вода, добавленная добавка, возраст, общее количество оборотов, общее количество оборотов при скорости перемешивания с момента последнего добавления воды.Все данные должны быть на начало разряда.
- Отслеживайте осадку бетона с точностью +/- 1 дюйм (25 мм). Оборудование должно получить одно или несколько физических измерений автобетоносмесителя, относящихся к просадке бетона, и обеспечить индикацию просадки на основе заранее установленных корреляций.Оборудование должно иметь точность от 50% до 100% объема смесительного барабана. По запросу поставщик бетона должен предоставить данные не старше 24 месяцев, подтверждающие точность калибровки для каждого типа грузовика.
Руководство по надлежащей производственной практике для лекарственных препаратов (GUI-0001)
Заявление об ограничении ответственности
Этот документ не является частью Закона о пищевых продуктах и лекарствах (Закон) или его нормативных актов, и в случае любого несоответствия или противоречия между Законом или нормативными актами и настоящим документом преимущественную силу имеют Закон или постановления. Этот документ является административным документом, который предназначен для облегчения соблюдения регулируемой стороной Закона, нормативных актов и применимых административных политик.
Содержание
- Об этом документе
- Об управлении качеством
- Руководство
- Приложения
- Приложение A — Глоссарий
- Приложение B — Вопросы и ответы
- Помещение — C.02.004
- Оборудование — C.02.005
- Персонал — C.02.006
- Санитария — C.02.007, C.02.008
- Испытание сырья — C.02.009, C.02.010
- Производственный контроль — C.02.011, C.02.012
- Отдел контроля качества — C.02.013, C.02.014, C.02015
- Испытания упаковочного материала — C.02.016, C.02.017
- Испытания готовой продукции — C.02.018, C.02.019
- Записи — C.02.020, C.02.021, C.02.022, C.02.023, C.02.024, C.02.024.1
- Образцы — C.02.025, C.02.026
- Стабильность — C.02.027, C.02.028
- Стерильные изделия — C.02.029
- Приложение C — Ссылки
В следующей таблице показаны три типа значков, используемых в этом документе, и способы их использования.
Важно: Ключевая или предостерегающая информация для людей.
Информация: Дополнительная информация, например, цитаты и юридические ссылки.
Совет: То, что люди должны делать или понимать.
Об этом документе
1. Назначение
Это руководство предназначено для людей, которые работают с лекарствами как:
- производители
- упаковщики
- этикетировщики
- тестеры
- дистрибьюторов
- импортеров
- оптовики
Это поможет вам понять и соблюдать часть C, раздел 2 Правил по продуктам и лекарствам (Правила), которая касается надлежащей производственной практики (GMP).Вы можете найти определения терминов, используемых в этом руководстве, в Приложении A.
2. Сфера применения
Настоящее руководство распространяется на следующие типы лекарств:
- фармацевтическая
- радиофармпрепараты
- биологический
- ветеринарная
3. Введение
Настоящее руководство интерпретирует требования надлежащей производственной практики (GMP) в части C, раздел 2 Правил. Они были разработаны Министерством здравоохранения Канады в консультации с заинтересованными сторонами.
Руководящие документы, подобные этому, призваны помочь профессионалам отрасли и здравоохранения понять, как соблюдать нормативные требования. Они также служат руководством для сотрудников Министерства здравоохранения Канады, чтобы правила соблюдались справедливо, последовательно и эффективно по всей Канаде.
Health Canada проверяет предприятия на предмет их соответствия Закону о пищевых продуктах и лекарствах (Закон) и связанным с ним нормативным актам. Когда мы проводим инспекцию, мы будем использовать этот документ в качестве руководства для оценки вашего соответствия требованиям GMP.
Эти рекомендации — не единственный способ интерпретации правил GMP, и они не предназначены для охвата всех возможных случаев. Другие способы соблюдения правил GMP будут рассмотрены при наличии надлежащего научного обоснования. Кроме того, по мере появления новых технологий могут потребоваться различные подходы.
Руководящие документы являются административными и не имеют силы закона. Благодаря этому они допускают гибкий подход. Поэтому используйте это руководство, чтобы помочь вам разработать конкретные подходы, отвечающие вашим уникальным потребностям.
Руководство в этом документе было написано с целью гармонизации со стандартами GMP из:
- Всемирная организация здравоохранения (ВОЗ)
- Схема сотрудничества в области фармацевтических инспекций (PIC / S)
- Международный совет по гармонизации (ICH)
- Международное сотрудничество по гармонизации технических требований к регистрации ветеринарных лекарственных препаратов (VICH)
- другие регулирующие органы в других странах
В этом документе также учтены действующие соглашения о взаимном признании (MRA) между Министерством здравоохранения Канады и другими международными регулирующими органами, а также соглашения с другими сторонами.
В этом издании отражены недавние нормативные поправки, проясняются существующие требования, включены общие вопросы отрасли и представлен обновленный список приложений.
Контрольный список — Правила GMP по видам деятельности
| Раздел | Постановление | F | P / L | I | D | Вт | т |
|---|---|---|---|---|---|---|---|
| Помещения | С.02.004 | – | |||||
| Оборудование | C.02.005 | – | – | – | |||
| Персонал | C.02.006 | ||||||
| Санитария | С.02.007 | – | – | – | – | ||
| C.02.008 | – | – | – | – | |||
| Тестирование сырья | C.02.009 | – | – | – | – | * | |
| С.02.010 | – | – | – | – | * | ||
| Производственный контроль | C.02.011 | – | – | ||||
| C.02.012 | – | ||||||
| ОТК | С.02.013 | – | |||||
| C.02.014 | – | ||||||
| C.02.015 | |||||||
| Тестирование упаковочного материала | С.02.016 | – | – | – | * | ||
| C.02.017 | – | – | – | * | |||
| Тестирование готовой продукции | C.02.018 | – | * | ||||
| С.02.019 | – | – | * | ||||
| Записи | C.02.020 | – | |||||
| C.02.021 | |||||||
| С.02.022 | – | – | – | ||||
| C.02.023 | – | ||||||
| C.02.024 | – | ||||||
| Образцы | С.02.025 | – | – | – | |||
| C.02.026 | – | – | – | ||||
| Устойчивость | C.02.027 | – | – | – | * | ||
| С.02.028 | – | – | – | * | |||
| Стерильные изделия | C.02.029 | – | – | – | * | ||
| |||||||
Об управлении качеством
4. Фармацевтическая система качества
Руководящие принципы
Имеете ли вы лицензию на предприятие или ведете деятельность, регулируемую Частью C, Разделом 2 Правил по пищевым продуктам и лекарствам? Если вы это сделаете, вы должны убедиться, что соблюдаете эти требования — а также разрешение на маркетинг или клинические испытания — при производстве, упаковке, маркировке, импорте, распространении, тестировании и оптовой продаже лекарств.Вы не должны подвергать потребителей риску из-за низкой безопасности, качества, эффективности или несоблюдения нормативных требований.
Вы несете ответственность за соблюдение требований, изложенных в Правилах и разъясненных в данном руководстве. Вам также понадобится помощь и приверженность ваших поставщиков и персонала на всех уровнях вашего предприятия.
Для соответствия требованиям вам необходимо:
- иметь хорошо спроектированную и правильно внедренную фармацевтическую систему качества (также известную как система управления качеством), которая включает надлежащую производственную практику (GMP) и управление рисками для качества.
- полностью документировать фармацевтическую систему качества и контролировать ее эффективность
- убедитесь, что вся ваша фармацевтическая система качества должным образом укомплектована квалифицированным персоналом и подходящими / достаточными помещениями, оборудованием и помещениями.
Основные концепции управления качеством, надлежащей производственной практики и управления рисками для качества взаимосвязаны.Они описаны здесь, чтобы подчеркнуть их взаимосвязь и фундаментальную важность для производства наркотиков и контроля над ними.
Разработка фармацевтической системы качества
Управление качеством — это обширная концепция. Он охватывает все вопросы, которые индивидуально или в совокупности влияют на качество лекарства. Это совокупность мер, направленных на обеспечение качества лекарств, необходимых для их предполагаемого использования. Он включает в себя GMP.
GMP применяется на всех этапах жизненного цикла лекарственного препарата: от производства исследуемых лекарств до передачи технологии, коммерческого производства и прекращения выпуска продукта.Фармацевтическая система качества может даже распространяться на стадию жизненного цикла фармацевтической разработки (как описано в ICH Q10: Pharmaceutical Quality System ). Это должно стимулировать инновации и постоянное совершенствование, одновременно укрепляя связь между фармацевтическими разработками и полномасштабной производственной деятельностью.
Вы должны учитывать размер и сложность деятельности вашей компании при разработке новой фармацевтической системы качества или изменении существующей.Дизайн системы должен включать принципы управления рисками, включая использование соответствующих инструментов. Хотя некоторые аспекты системы могут быть общекорпоративными, а другие — специфическими для сайта, эффективность системы обычно подтверждается на уровне сайта.
Чтобы обеспечить правильную настройку вашей фармацевтической системы качества для производства, упаковки, маркировки, тестирования, распространения, импорта или оптовой продажи лекарств, вам необходимо:
- Проектируйте, планируйте, внедряйте, поддерживайте и постоянно улучшайте вашу систему, чтобы обеспечить постоянную поставку продуктов с надлежащими характеристиками качества.
- Управляйте знаниями о продуктах и процессах на всех этапах жизненного цикла.
- Разрабатывать и разрабатывать лекарственные препараты с учетом требований GMP.
- Четко обозначьте обязанности руководства.
- Принять меры для:
- производство, поставка и использование правильных исходных и упаковочных материалов
- Выбор и мониторинг поставщиков
- подтверждение того, что каждая поставка осуществляется из утвержденной цепочки поставок
- Обеспечьте наличие процессов для надлежащего управления деятельностью, переданной на аутсорсинг.
- Установите и поддерживайте состояние контроля, разрабатывая и используя эффективные системы мониторинга и контроля за производительностью процессов и качеством продукции.
- Учитывать результаты мониторинга продуктов и процессов при выпуске партий и расследовании отклонений. Это позволит принять превентивные меры, чтобы избежать возможных отклонений в будущем.
- Выполнять все необходимые проверки промежуточных продуктов, а также любые другие внутрипроизводственные проверки и проверки.
- Обеспечьте постоянное улучшение, внося улучшения качества в соответствии с текущим уровнем знаний о процессах и продуктах.
- Примите меры для оценки и утверждения запланированных изменений перед их внедрением. Нормативное уведомление и утверждение изменений должны осуществляться по мере необходимости.
- После внедрения любого изменения проведите оценку, чтобы подтвердить, что ваши цели в области качества были достигнуты. Убедитесь, что не было непреднамеренного негативного воздействия на качество продукта во время выпуска и в течение срока его хранения.
- Применяйте соответствующий уровень анализа первопричин при расследовании отклонений, предполагаемых дефектов продукта и других проблем. Это можно определить, используя принципы управления рисками для качества. В случаях, когда истинную основную причину (ы) проблемы определить невозможно, определите наиболее вероятную основную причину (ы) и устраните их.
- Если предполагается или определяется человеческая ошибка как причина, это должно быть обосновано объективными доказательствами. Убедитесь, что не были упущены из виду процессные, процедурные или системные ошибки или проблемы, если таковые имеются.
- Определите полное влияние отклонения и задокументируйте, как вы пришли к своему выводу.
- Определить и выполнить соответствующие корректирующие и / или предупреждающие действия в ответ на расследования. Контролировать и оценивать эффективность таких действий в соответствии с принципами управления рисками для качества.
- Убедитесь, что отдел контроля качества одобряет каждую производственную партию лекарств, прежде чем продавать или поставлять их.Вы должны производить и контролировать лекарства в соответствии с требованиями регистрационного удостоверения и любыми другими нормативными актами, относящимися к производству, контролю и выпуску лекарств.
- Убедитесь, что лекарства — и материалы, которые используются для их изготовления и упаковки — хранятся, распределяются и обрабатываются должным образом, чтобы качество сохранялось на протяжении всего срока их годности.
- Внедрите процесс самопроверки и / или аудита качества, чтобы регулярно оценивать эффективность и применимость вашей фармацевтической системы качества.
- Обеспечить активное участие высшего руководства в системе качества фармацевтики. Их лидерство имеет важное значение, поскольку они в конечном итоге несут ответственность за обеспечение эффективной системы качества фармацевтической продукции. Это включает в себя обеспечение надлежащего финансирования системы и определение, передачу и реализацию ролей, обязанностей и полномочий по всей вашей организации. Высшее руководство также должно гарантировать, что персонал — на всех уровнях и на всех участках в вашей организации — поддерживает и привержен системе качества фармацевтической продукции.
- Поручите высшему руководству периодически проводить анализ деятельности системы качества фармацевтики, чтобы постоянно выявлять риски и возможности для улучшения продуктов, процессов и самой системы.
- Определите и задокументируйте свою фармацевтическую систему качества. У вас должно быть руководство по качеству или эквивалентная документация, содержащая описание системы, включая обязанности руководства.
Надлежащая практика производства лекарств
Надлежащая производственная практика (GMP) является частью гарантии качества.Они обеспечивают постоянное производство и контроль над наркотиками. Лекарства должны соответствовать стандартам качества для их предполагаемого использования, как указано в разрешении на продажу, разрешении на клинические испытания или спецификации продукта.
GMP касается как производства, так и контроля качества. Для соответствия требованиям GMP необходимо:
- Четко определите все производственные процессы. Систематически пересматривайте их в свете опыта. Покажите, что они способны постоянно производить лекарства требуемого качества, соответствующие их спецификациям.
- Подтвердите критические этапы производственных процессов и ключевые изменения в процессе.
- Обеспечивает все ключевые элементы GMP, включая:
- квалифицированный и обученный персонал
- Достаточное помещение и площадь
- подходящее оборудование и услуги
- подходящие материалы, тара и этикетки
- утвержденные процедуры и инструкции
- подходит для хранения и транспортировки
- Напишите пошаговые инструкции и процедуры четким и прямым языком, особенно применимые к используемым объектам.
- Обучить операторов правильному выполнению процедур. Убедитесь, что они понимают важность соблюдения требований GMP как части своей роли в обеспечении безопасности пациентов.
- Создавать записи (вручную и / или записывающими приборами) во время производства. Покажите, что все шаги, требуемые определенными процедурами и инструкциями, были фактически выполнены и соответствовали соответствующим параметрам и / или атрибутам качества. Покажите, что количество и качество препарата соответствуют ожиданиям.
- Задокументируйте любые отклонения. Изучите значительные отклонения, чтобы определить первопричину и последствия. Убедитесь, что приняты надлежащие корректирующие и предупреждающие действия.
- Храните записи о производстве, упаковке, маркировке, тестировании, распространении, импорте и оптовой продаже в простой для понимания и доступной форме. Это позволяет проследить полную историю партии.
- Распространять продукцию таким образом, чтобы сводить к минимуму любой риск для ее качества и учитывать передовую практику производства Канады, которая включает в себя передовую практику распределения.
- Контролировать хранение, обращение и транспортировку лекарств и их ингредиентов, чтобы свести к минимуму любой риск для их качества.
- Наличие системы отзыва лекарств из продажи.
- Рассмотреть жалобы на наркотики. Выясните причины дефектов качества. Примите соответствующие меры, чтобы проблемы не повторились.
Контроль качества
Контроль качества — это часть GMP, которая касается:
- отбор проб
- технические характеристики
- тестирование
- документация
- процедуры выпуска
Вы можете разрешать выпускать сырье, упаковочные материалы и продукты для использования или продажи только в том случае, если их качество является удовлетворительным.Контроль качества гарантирует, что вы проведете необходимые и соответствующие тесты для обеспечения качества. Это делается не только в лабораториях — вы должны включать контроль качества во все действия и решения относительно качества ваших продуктов.
Для выполнения основных требований контроля качества необходимо:
- Убедитесь, что у вас есть соответствующие помещения, обученный персонал и утвержденные процедуры для отбора проб и испытаний сырья, упаковочных материалов, промежуточных сыпучих и готовых продуктов, а также, где это необходимо, для мониторинга условий окружающей среды.
- Взять пробы сырья, упаковочных материалов, промежуточных, сыпучих и готовых продуктов с использованием уполномоченного персонала и утвержденных методов.
- Подтвердить методы испытаний. Квалифицировать оборудование, инструменты и компьютерные системы для их использования по назначению.
- Вести записи (вручную и / или с помощью регистрирующих приборов), чтобы показать, что вы выполнили все необходимые процедуры отбора проб, проверки и тестирования. Запишите и исследуйте любые отклонения.
- Убедитесь, что готовые продукты содержат активные ингредиенты, соответствующие качественному и количественному составу, указанному в разрешении на маркетинг или клиническое исследование.Убедитесь, что они имеют требуемую чистоту, заключены в соответствующие контейнеры, имеют правильную маркировку и хранятся.
- Задокументируйте результаты проверки и тестирования промежуточных, объемных и готовых продуктов и материалов в соответствии со спецификациями.
- Включите в процедуры выпуска продукции обзор и оценку соответствующей производственной документации, а также оценку отклонений от установленных процедур.
- Не выпускайте лекарства для продажи или поставки до тех пор, пока они не будут одобрены вашим отделом контроля качества.
- Храните достаточное количество образцов сырья и готовой продукции, чтобы в случае необходимости можно было провести экспертизу.
Управление рисками качества
Управление рисками для качества — это систематический процесс оценки, контроля, информирования и анализа рисков для качества лекарственного средства на протяжении всего жизненного цикла продукта. Его можно применять как проактивно, так и ретроспективно.
Принципы управления рисками для качества следующие:
- Оценка риска для качества основана на научных знаниях и опыте работы с процессом и, в конечном итоге, связана с защитой пациента.
- Уровень усилий, формальности и документирования процесса менеджмента риска для качества соизмерим с уровнем риска.
Руководство
5. Постановление
Для каждого раздела ниже сначала приводится точный текст из Части C, Раздел 2 Правил по пищевым продуктам и лекарствам (Правила). За этим следует обоснование (почему это правило важно) и интерпретация Министерства здравоохранения Канады (что вам следует делать, чтобы соответствовать требованиям), где это необходимо.
С.02.002
В этом дивизионе,
- «медицинский газ» означает любой газ или смесь газов, произведенную, проданную или представленную для использования в качестве лекарственного средства;
- «упаковочный материал» включает этикетку;
- «спецификации» означает подробное описание лекарственного средства, сырья, используемого в лекарственном средстве, или упаковочного материала для лекарственного средства, и включает:
- заявление обо всех свойствах и качествах лекарственного средства, сырья или упаковочного материала, которые имеют отношение к производству, упаковке и применению лекарственного средства, включая идентичность, эффективность и чистоту лекарственного средства, сырья или упаковки. материал,
- — подробное описание методов, используемых для тестирования и исследования лекарственного средства, сырья или упаковочного материала, а
- — заявление о допусках на свойства и качество лекарственного средства, сырья или упаковочного материала.
С.02.002.1
Этот раздел не распространяется на изготовление, упаковку / маркировку, тестирование, хранение и импорт противомикробных агентов.
Распродажа
С.02.003
Ни один дистрибьютор, упомянутый в параграфе C.01A.003 (b) , и ни один импортер не должны продавать лекарство, если оно не было изготовлено, упаковано / маркировано, протестировано и хранилось в соответствии с требованиями этого Раздела.
С.02.003.1
Ни одно лицо не может продавать лекарство, которое оно изготовило, упаковало / маркировало, протестировало или хранило, если оно не было изготовлено, упаковано / маркировано, протестировано или сохранено в соответствии с требованиями этого Раздела.
С.02.003.2
- Никто не может импортировать активный ингредиент в Канаду с целью продажи, если у него нет в Канаде лица, ответственного за его продажу.
- Ни одно лицо, импортирующее активный ингредиент в Канаду, не должно продавать его партию или партию, если на его этикетке не указано следующее:
- имя и гражданский адрес импортера; и
- наименование и адрес основного места деятельности в Канаде лица, ответственного за его продажу.
Использование в производстве
С.02.003.3
Ни одно лицо не должно использовать активный ингредиент при изготовлении лекарственного средства, если оно не изготовлено, не упаковано / не маркировано, не испытано и не хранится в соответствии с требованиями этого Раздела.
Помещение
С.02.004
Помещения, в которых производятся, упаковываются / маркируются или хранятся партия или партия лекарственного средства, должны быть спроектированы, построены и обслуживаться таким образом, чтобы
- разрешает выполнение операций в чистых, санитарных и упорядоченных условиях;
- позволяет эффективно очищать все поверхности; и
- предотвращает загрязнение лекарственного средства и добавление посторонних веществ в лекарственное средство.
Обоснование
Ваше заведение должно быть спроектировано и построено таким образом, чтобы обеспечивать чистоту и порядок и предотвращать заражение. Требуется регулярный уход, чтобы не допустить порчи помещения. Основная цель этих усилий — качество продукции.
Интерпретация
- Примите соответствующие меры для минимизации рисков, связанных с проектированием и расположением здания, включая меры по предотвращению загрязнения и смешивания материалов или лекарств.
- Убедитесь, что ваши помещения спроектированы, построены и содержатся таким образом, чтобы предотвратить проникновение вредителей или посторонних материалов в здание (или из одного места в другое).
- Убедитесь, что в дверях, окнах, стенах, потолках и полах нет отверстий или трещин (кроме предусмотренных конструкцией).
- Используйте двери, обеспечивающие прямой доступ наружу из производственных и упаковочных зон только в экстренных случаях. Убедитесь, что эти двери плотно закрыты.Убедитесь, что зоны приема и отгрузки не допускают прямого доступа к производственным площадям.
- Отделить производственные площади от всех непроизводственных. Четко определите отдельные зоны производства, упаковки и тестирования и при необходимости разделите их. Зоны, в которых проводятся биологические, микробиологические или радиоизотопные испытания, требуют особого подхода к проектированию и защите.
- Не размещайте другие подразделения (например, научно-исследовательские лаборатории, диагностические лаборатории и помещения для лабораторных животных) в том же здании, что и производственные помещения, если вы не примете достаточно мер для предотвращения перекрестного заражения.(См. Интерпретацию 11 относительно необходимых мер перекрестного загрязнения.)
- Отделите механические участки, такие как котельные, генераторы и другие инженерные помещения, от производственных участков.
- Принять меры для предотвращения заражения во всех областях, где подвергается воздействию сырье, первичные упаковочные материалы, лекарственные средства в процессе производства или лекарственные препараты (в необходимой степени).
- Убедитесь, что пол, стены и потолок можно мыть. Герметизируйте кирпич, цементные блоки и другие пористые материалы.Избегайте поверхностных материалов, которые сбрасывают частицы.
- Убедитесь, что пол, стены, потолок и другие поверхности твердые, гладкие и не имеют острых углов, где может собираться посторонний материал.
- Заделать стыки между стенами, потолком и полом.
- Убедитесь, что трубы, осветительная арматура, точки вентиляции и другие объекты обслуживания не создают поверхностей, которые невозможно очистить.
- Решетчатые и сливные трапы в полу.
- Поддерживайте качество воздуха, контролируя пыль, отслеживая перепады давления между производственными помещениями (в том числе между производственными и непроизводственными зонами), а также периодически проверяя и заменяя воздушные фильтры.Убедитесь, что ваша система обработки воздуха четко определена с учетом объема, направления, скорости воздушного потока и необходимости предотвращения перекрестного загрязнения. Периодически проверяйте системы обработки воздуха, чтобы убедиться, что они соответствуют проектным требованиям. Вести учет.
- Контролируйте температуру и влажность до степени, необходимой для защиты материалов и надежности производственных процессов.
- Отдельные зоны приема пищи, отдыха, переодевания, умывальника и туалеты от производственных помещений.Убедитесь, что они подходящего размера, хорошо вентилируются и соответствуют санитарным нормам.
- Разработайте макет сайта, чтобы избежать путаницы и оптимизировать поток персонала и материалов. Удостовериться:
- Достаточно места для приема, хранения и всей производственной деятельности.
- Рабочие места позволяют упорядоченно и логично размещать материалы и оборудование (включая детали и инструменты).
- Там, где используются физические карантинные зоны, они хорошо обозначены и изолированы, с доступом только для назначенного персонала.Электронный доступ к изменению контроля состояния карантинной инвентаризации ограничен назначенным персоналом.
- Для сырья предусмотрена отдельная площадка для отбора проб. Если отбор проб производится в зоне хранения, это делается таким образом, чтобы предотвратить загрязнение или перекрестное загрязнение.
- Рабочие зоны хорошо освещены.
- Перемещение персонала, оборудования и материалов предназначено для предотвращения заражения. Особое внимание следует уделять перемещению между автономными и другими объектами — это должно быть минимизировано и может потребоваться участки для дезактивации.
- Укажите в своем Генеральном плане валидации и квалифицируйте коммунальные услуги и вспомогательные системы для зданий, где лекарства производятся, упаковываются / маркируются. Это включает в себя отопление, вентиляцию и кондиционирование воздуха, пылеулавливание и поставки очищенной воды, воды для инъекций, пара, сжатого воздуха, азота и т. Д. Выполняйте периодические проверки и ведите записи. Дополнительные инструкции см. В Руководстве по валидации — лекарственные препараты и вспомогательная деятельность (GUI-0029) .
- Четко идентифицируйте состав систем распределения жидкостей и газов на их выпусках.
- Поддерживать помещение в хорошем состоянии. Убедитесь, что операции по ремонту и техническому обслуживанию не влияют на качество лекарств.
- Обеспечить и содержать отдельные помещения (где необходимо) для защиты оборудования и систем управления, чувствительных к вибрации, электрическим помехам и контакту с чрезмерной влажностью или другими внешними факторами.
- Если вы производитель или упаковщик, вы должны показать, что ваше помещение спроектировано таким образом, чтобы сводить к минимуму риск загрязнения между продуктами (т.е. перекрестное загрязнение).
- Используйте подход к управлению рисками для качества для оценки и контроля рисков перекрестного заражения. Основывайте это на оценке производимых продуктов (например, на эффективности и токсикологической оценке). Примите во внимание такие факторы, как:
- проектирование и использование объекта / оборудования
- персонал и материальный поток
- Микробиологический контроль
- Физико-химические и токсикологические свойства используемых материалов
- характеристики процесса
- процессов очистки
- аналитические возможности
Результат вашего процесса управления рисками для качества должен помочь вам определить потребность и степень, в которой помещения и оборудование должны быть выделены для конкретного продукта или семейства продуктов.Это может включать выделение либо конкретных частей, контактирующих с продуктом, либо всего производственного предприятия. Возможно, будет приемлемым ограничить производственную деятельность отдельной, автономной производственной зоной в пределах многопродуктового предприятия, если вы можете это оправдать.
- Автономные помещения необходимы, если продукт представляет собой риск:
- , которые невозможно контролировать с помощью оперативных и / или технических мер
- , если научные данные не подтверждают безопасное пороговое значение токсичности
- , где пороговые значения, полученные в результате токсикологической оценки, ниже уровней обнаружения
- для некоторых классов высокочувствительных препаратов (таких как пенициллины и цефалоспорины)
- Убедитесь, что внешнее загрязнение остатками лекарственного препарата не превышает установленных пределов для конечной тары и первичной упаковки (для ситуаций, перечисленных в интерпретации 11.б). Вы можете хранить продукты в местах общего пользования после того, как они будут помещены в конечные контейнеры и будут приняты меры для минимизации рисков перекрестного заражения.
- Убедитесь, что производство высокотоксичных нефармацевтических материалов (таких как пестициды и гербициды) не производится в помещениях, используемых для производства лекарств.
- Используйте подход к управлению рисками для качества для оценки и контроля рисков перекрестного заражения. Основывайте это на оценке производимых продуктов (например, на эффективности и токсикологической оценке). Примите во внимание такие факторы, как:
Оборудование
С.02.005
Оборудование, с помощью которого производится, упаковывается / маркируется или тестируется партия или партия лекарственного средства, должно быть спроектировано, сконструировано, обслуживаться, эксплуатироваться и располагаться таким образом, чтобы
- позволяет эффективно очищать свои поверхности;
- предотвращает загрязнение препарата и добавление посторонних веществ в препарат; и
- позволяет ему функционировать в соответствии с назначением.
Обоснование
Чтобы производить лекарства постоянного качества, вы должны убедиться, что ваше оборудование подходит для предполагаемого использования и работает так, как задумано.
Эти требования предназначены для предотвращения заражения лекарств:
- другие препараты
- пыль и другие загрязнители в воздухе
- посторонних материалов, таких как:
- ржавчина
- смазка
- частиц, поступающих из оборудования
Загрязнение также может быть вызвано плохим обслуживанием, неправильным использованием оборудования, превышением его возможностей и использованием изношенного оборудования.
Упорядоченное размещение оборудования упрощает очистку прилегающих участков и позволяет избежать помех другим операциям обработки. Это также сводит к минимуму перемещение персонала и оптимизирует поток материалов.
Интерпретация
- Убедитесь, что конструкция, конструкция и расположение вашего оборудования позволяют проводить очистку, санитарную обработку и осмотр оборудования.
- Убедитесь, что детали оборудования, контактирующие с сырьем, промежуточными продуктами или лекарствами, можно мыть.
- Убедитесь, что резервуары, используемые для обработки жидкостей и мазей, оснащены фитингами, которые можно разбирать и очищать. Убедитесь, что утвержденное оборудование для очистки на месте (CIP) можно разобрать для периодической проверки.
- Убедитесь, что фильтрующие узлы легко разбираются.
- Размещайте оборудование достаточно далеко от другого оборудования и стен, чтобы можно было очистить оборудование и прилегающую территорию.
- Тщательно закройте основание неподвижного оборудования по точкам контакта с полом.
- При хранении оборудование должно быть чистым, сухим и защищенным от загрязнения.
- Убедитесь, что оборудование не добавляет к препарату посторонние вещества. Убедись, что:
- Поверхности, контактирующие с сырьем, промежуточными продуктами или лекарствами, гладкие и изготовлены из нетоксичного, коррозионно-стойкого, нереагирующего на лекарственное средство, которое изготавливается или упаковывается, и способны выдерживать многократную очистку или дезинфекцию Конструкция оборудования
- сводит к минимуму возможность загрязнения лекарственного средства смазкой или другим ремонтным материалом
- Оборудование, изготовленное из материала, который склонен к рассыпанию частиц или укрывательству микроорганизмов, не вступает в контакт и не загрязняет сырье, лекарственные средства в процессе производства или лекарственные средства Оборудование
- должно подлежать соответствующему контролю там, где существует риск загрязнения металлами (например,грамм. использовать металлоискатели при таблетировании)
- Цепные приводы и шестерни трансмиссии закрыты или надлежащим образом закрыты
- цистерны, бункеры и другое аналогичное технологическое оборудование снабжены крышками
- Эксплуатируйте оборудование так, чтобы предотвратить загрязнение.
- Убедитесь, что печи, автоклавы и подобное оборудование содержат только одно сырье, лекарство в процессе обработки или лекарство за раз (если не приняты меры для предотвращения загрязнения и смешивания).
- Размещайте оборудование таким образом, чтобы предотвратить его загрязнение посторонними материалами.
- Разместите оборудование таким образом, чтобы оптимизировать поток материала и свести к минимуму перемещение персонала.
- Размещайте оборудование таким образом, чтобы производственные операции в одной и той же зоне были совместимы и не допускали перекрестного загрязнения между операциями.
- Четко пометьте неподвижные трубопроводы, чтобы указать содержимое и (если применимо) направление потока.
- При необходимости предоставить специализированное производственное оборудование.
- Управляйте оборудованием для очистки, хранения и распределения воды таким образом, чтобы обеспечить надежный источник воды соответствующей химической и микробиологической чистоты.
- Поддерживать оборудование в исправном состоянии.
- Убедитесь, что на поверхностях оборудования нет трещин, отслаивания краски и других дефектов.
- Убедитесь, что прокладки исправны.
- Избегайте использования временных приспособлений (например, ленты).
- Уход за деталями оборудования, контактирующими с лекарствами, чтобы гарантировать, что лекарства изготовлены или упакованы таким образом, чтобы не допустить заражения.
- Выполнять техническое обслуживание оборудования, используемого для значительных технологических операций или испытаний, в соответствии с письменной программой профилактического обслуживания. Ведите записи об обслуживании.
- Проектируйте, размещайте и обслуживайте оборудование так, чтобы оно служило своему прямому назначению.
- Убедитесь, что измерительные приборы имеют надлежащий диапазон, точность и точность. Калибруйте это оборудование по графику и ведите записи.
- Убрать оборудование, непригодное для использования по назначению, из зон изготовления, упаковки / маркировки и испытаний. Если удаление невозможно, четко обозначьте оборудование как непригодное.
- Убедитесь, что оборудование, используемое на критических этапах изготовления, упаковки / маркировки и тестирования (включая компьютеризированные системы), подлежит квалификации (как указано в вашем Генеральном плане валидации).Документируйте всю квалификацию оборудования. Для получения дополнительной информации см. Руководство по валидации — лекарственные препараты и вспомогательная деятельность (GUI-0029) и Приложение 11 PIC / S: Компьютеризированные системы .
Требования к компьютеризированным системам подробно описаны в разделе C.02.015 «Отдел контроля качества», интерпретация 8.f и раздел C.02.020 – C02.024.1, интерпретация с 5 по 7 «Записи».
- Калибровать, проверять или проверять оборудование, используемое для важных операций по обработке и тестированию, в соответствии с письменной программой.Вести учет. Убедитесь, что система поддерживает идентификацию статуса калибровки (вы можете использовать метку статуса (тег) или какой-либо другой метод).
- Укажите оборудование, используемое для обработки или тестирования, с помощью уникального номера или кода и ведите журналы использования. Эти журналы должны включать идентификацию продуктов, даты эксплуатации, чистки и простоев из-за частых или серьезных неисправностей или поломок. Собранная информация поможет выявить негативные тенденции в производительности.
Персонал
C.02.006
Каждая партия или партия лекарственного средства должна быть изготовлена, упакована / маркирована, испытана и храниться под контролем персонала, который, с учетом своих обязанностей и ответственности, прошел такую техническую, академическую и другую подготовку, которую министр считает удовлетворительной. в интересах здоровья потребителя или покупателя.
Обоснование
Ваше высшее руководство несет ответственность за предоставление необходимых ресурсов (материалов, персонала, помещений и оборудования).Они должны постоянно контролировать и повышать эффективность вашей фармацевтической системы качества.
Тот, кого вы нанимаете, является одним из важнейших элементов любой фармацевтической операции. Без надлежащего персонала с качественным мышлением и обучением практически невозможно производить, упаковывать / маркировать, тестировать или хранить лекарства хорошего качества.
Очень важно, чтобы производство лекарств контролировали только квалифицированные сотрудники. Эти операции носят сугубо технический характер и требуют постоянной бдительности, внимания к деталям и высокой степени компетентности сотрудников.Причина, по которой продукция часто не соответствует требуемым стандартам, заключается в плохо обученном персонале или непонимании важности контроля производства.
Интерпретация
- Лицо, отвечающее за ваш отдел контроля качества (если вы производитель, упаковщик / этикетировщик, испытатель, импортер или дистрибьютор) и лицо, отвечающее за ваш производственный отдел (если вы производитель или упаковщик / этикетировщик):
- должен иметь высшее образование; в Канаде это должна быть степень канадского университета или степень, признанная эквивалентной канадским университетом или канадским органом по аккредитации в области науки, связанной с выполняемой работой
- должны иметь практический опыт в своей сфере ответственности
- непосредственно контролирует и лично контролирует на месте каждую рабочую смену, в течение которой проводятся действия под их контролем (для импортеров и дистрибьюторов ответственное лицо может находиться за пределами Канады, если они полностью доступны для отдела контроля качества и имеют достаточно знание операций на месте для выполнения должностных обязанностей)
- может делегировать обязанности и ответственность (например, покрывать все смены) квалифицированному лицу, оставаясь при этом подотчетным за эти обязанности и ответственность (это лицо должно иметь диплом, сертификат или другое свидетельство формальной квалификации, присужденное после завершения курс обучения в университете, колледже или техническом институте в области науки, связанной с выполняемой работой, в сочетании с не менее двух лет соответствующего практического опыта)
- Ответственный за отдел контроля качества оптовой компании:
- должен иметь соответствующую академическую подготовку и опыт
- может делегировать обязанности и ответственность кому-либо, кто соответствует требованиям интерпретации 2.а
- Лицо, ответственное за упаковочные операции (включая контроль печатных упаковочных материалов и выдачу оптовых лекарств):
- должен иметь квалификацию по образованию и опыту
- несет прямую ответственность перед лицом, ответственным за производственный отдел (или лицом, имеющим такую же квалификацию)
- Персонал, отвечающий за вторичную маркировку и отдел контроля качества:
- должен иметь соответствующую академическую подготовку и опыт
- может делегировать свои обязанности и ответственность лицу, которое соответствует требованиям интерпретации 4.а
- Обеспечить наличие на объекте достаточного количества персонала с необходимой квалификацией и практическим опытом, соответствующим их обязанностям.
- Не возлагайте столько обязанностей на одного человека, что это может поставить под угрозу качество.
- Запишите конкретные обязанности всех ответственных сотрудников в письменном описании работы.
- Убедитесь, что персонал имеет право выполнять свои обязанности.
- Если ключевой персонал отсутствует, назначьте квалифицированных замен для выполнения своих обязанностей и функций.
- Убедитесь, что весь персонал, выполняющий мероприятия GMP, понимает письменные процедуры для этих действий.
- Ваш персонал должен знать принципы GMP, которые влияют на него. Они должны пройти начальное и непрерывное обучение в соответствии с их должностными обязанностями.
- Следуйте письменной программе и используйте квалифицированных инструкторов для обучения персонала (включая технический персонал, обслуживающий персонал и персонал по уборке).
- Периодически оценивайте эффективность непрерывного обучения.
- Обеспечьте обучение перед внедрением новых или пересмотренных стандартных операционных процедур (СОП).
- Вести записи обучения.
- Проведите специальное обучение персонала, работающего в областях, где работают с высокоактивными, токсичными, инфекционными или сенсибилизирующими материалами. Обеспечьте доступ к соответствующей информации (например, паспортам безопасности)
- Периодически проверяйте эффективность работы всего персонала.
- Консультанты и подрядчики должны иметь необходимую квалификацию, подготовку и опыт, чтобы консультировать по темам, для которых они нанимаются.
Санитарно-техническое обслуживание
С.02.007
- Каждое лицо, производящее или упаковывающее / маркирующее лекарство, должно иметь письменную программу санитарии, которая должна выполняться под контролем квалифицированного персонала.
- Программа санитарии, указанная в части (1), должна включать:
- процедуры очистки помещений, в которых производится или упаковывается / маркируется лекарственное средство, и оборудования, используемого при изготовлении или упаковке / маркировке лекарственного средства; и
- инструкции по санитарному производству и упаковке / маркировке лекарств, а также обращению с материалами, используемыми при производстве и упаковке / маркировке лекарств.
Обоснование
Санитария на фармацевтическом заводе влияет на качество лекарственных препаратов, а также на качество мышления сотрудников. Лекарственные препараты должны изготавливаться и упаковываться в зонах, свободных от загрязнения окружающей среды и заражения другими лекарствами.
Письменная программа санитарии обеспечивает некоторую уверенность в том, что на вашем предприятии поддерживается уровень чистоты, а также в соответствии с положениями разделов 8 «Лекарства» и 11 «Антисанитарное производство и т. Д., наркотиков »в Законе о пищевых продуктах и лекарствах № .
Интерпретация
- Убедитесь, что у вас есть письменная программа санитарии, доступная на месте, если вы производите или упаковываете / маркируете лекарства.
- Разработайте свою программу санитарии, используя принципы управления рисками для качества. Определите и уменьшите риски загрязнения при проектировании и эксплуатации вашего объекта (см. Интерпретацию 11, раздел C.02.004 «Помещения»). Ваша программа санитарии должна содержать процедуры, описывающие следующее:
- Требования к очистке, которые применяются ко всем производственным участкам вашего предприятия, с акцентом на производственные участки, требующие особого внимания
- Требования к технологическому оборудованию
- интервалы очистки
- средств для чистки и дезинфекции, вместе с их разбавлением и используемым оборудованием
- Обязанности любого внешнего подрядчика
- Порядок утилизации отходов и мусора
- Меры борьбы с вредителями
- меры предосторожности, необходимые для предотвращения заражения лекарственного средства при использовании родентицидов, инсектицидов и фумигационных агентов
- процедур микробиологического мониторинга и мониторинга окружающей среды (установленных на основе принципов менеджмента риска для качества), которые:
- определяют пределы предупреждений и действий в областях, где производятся или упаковываются чувствительные продукты
- описать деятельность по мониторингу для обеспечения соблюдения условий окружающей среды во время производства
- Персонал, ответственный за проведение очистных работ
- Убедитесь, что ваша программа санитарии реализована и эффективна для предотвращения антисанитарных условий.
- Подтвердите процедуры очистки производственного оборудования в соответствии с Руководством по валидации очистки Министерства здравоохранения Канады (GUI-0028) . Это руководство также содержит рекомендации по установлению допустимых пределов остатков продукта.
- Убедитесь, что остатки процесса очистки (например, моющие средства и растворители) удалены с оборудования.
- Обеспечить наличие доказательств, демонстрирующих, что регулярная чистка и хранение оборудования не допускают размножения микробов.
- Отфильтруйте дезинфицирующие и дезинфицирующие средства (например, изопропиловый спирт) для удаления спор там, где это необходимо.
- Валидация аналитических методов, используемых для обнаружения остатков или загрязняющих веществ. Вы можете найти руководство по валидации аналитических методов в ICH Q2: Валидация аналитических процедур: текст и методология или VICH GL2 Валидация аналитических процедур: методология , если применимо, или любой стандарт, указанный в Приложении B к Закону.
- Производство в рамках кампании может быть принято, если — для каждого продукта — предоставлено надлежащее обоснование, проведена валидация и имеются строгие проверенные меры контроля и мониторинга, которые показывают, что любой риск перекрестного заражения сведен к минимуму.
- Убедитесь, что персонал, контролирующий вашу программу санитарии:
- квалифицировано по образованию или опыту
- несет прямую ответственность перед лицом, имеющим квалификацию, описанную в разделе C.02.006 «Персонал».
- Содержат пыльные работы. Избегайте использования отдельных или переносных пылесборников на производственных участках, особенно при дозировании. Если вы все же используете их, убедитесь, что эффективность фильтрации выхлопных газов продемонстрирована, а агрегаты регулярно обслуживаются в соответствии с письменными утвержденными процедурами.
C.02.008
- Каждый человек, который производит или упаковывает / маркирует лекарство, должен иметь в письменной форме минимальные требования к здоровью и гигиене и одежде персонала, чтобы обеспечить чистое и гигиеничное производство и упаковку / маркировку лекарственного средства.
- Ни один человек не должен иметь доступа к любой области, где лекарство подвергается воздействию во время его изготовления или упаковки / маркировки, если это лицо
- страдает или является носителем инфекционной формы, или
- имеет открытое поражение на любой открытой поверхности тела.
Обоснование
Здоровье, поведение и одежда ваших сотрудников могут способствовать загрязнению продукции. Плохая личная гигиена сведет на нет даже лучшую программу санитарии и значительно увеличит риск загрязнения продукции.
Интерпретация
- Изложите минимальные медицинские требования в письменной форме.
- Убедитесь, что персонал, имеющий доступ к любой зоне, где лекарство подвергается воздействию во время изготовления или упаковки / маркировки, прошел тщательный медицинский осмотр перед началом работы.Сотрудники должны проходить периодические медицинские осмотры в соответствии с их должностными обязанностями. Обеспечить, чтобы квалифицированные медицинские работники, уполномоченные в соответствии с их профессиональной практикой, проводили медицинские обследования на инфекционные заболевания.
Вы не должны позволять никому, кто является известным носителем инфекционного заболевания, иметь доступ в любую зону, где подвергается воздействию наркотика.
Вероятность передачи болезни через лекарственный препарат зависит от характера заболевания и вида работы, которую выполняет человек.Некоторые заболевания могут передаваться через лекарственный препарат, если инфицированный человек не соблюдает надлежащие гигиенические процедуры. Возможно, вам потребуется проконсультироваться с врачом.
Человек также может быть носителем инфекционного заболевания и не осознавать его. Поэтому в дополнение к строгим процедурам личной гигиены у вас должны быть системы, обеспечивающие эффективный барьер, предотвращающий загрязнение продукта. Весь персонал должен всегда соблюдать эти процедуры.Если выясняется, что сотрудник является носителем инфекционного заболевания, обратитесь в Министерство здравоохранения Канады и проведите оценку риска, чтобы определить, есть ли какое-либо воздействие продукта.
- Попросите сотрудников сообщать своему руководителю обо всех состояниях здоровья, которые могут отрицательно повлиять на лекарственные препараты.
- Проводить надзорные проверки, чтобы предотвратить обращение с открытыми материалами и лекарствами лицами с явными заболеваниями или открытыми поражениями, которые могут отрицательно повлиять на качество лекарств.Человек не должен иметь дело с открытым сырьем, первичными упаковочными материалами, лекарствами в процессе производства или лекарствами до тех пор, пока состояние не перестанет быть опасным.
- Оцените состояние здоровья каждого сотрудника, прежде чем разрешить ему вернуться на рабочее место после отсутствия из-за болезни, которая может отрицательно повлиять на качество продукции.
- Убедитесь, что существует процедура, описывающая, какие действия следует предпринять, если у человека, который работал с незащищенным сырьем, первичными упаковочными материалами, находящимися в процессе обработки лекарствами или лекарствами, обнаружено инфекционное заболевание.
- Обеспечьте, чтобы весь персонал, проводящий визуальные проверки, проходил периодические проверки зрения и / или периодическую переквалификацию.
- Убедитесь, что персонал, имеющий доступ к любой зоне, где лекарство подвергается воздействию во время изготовления или упаковки / маркировки, прошел тщательный медицинский осмотр перед началом работы.Сотрудники должны проходить периодические медицинские осмотры в соответствии с их должностными обязанностями. Обеспечить, чтобы квалифицированные медицинские работники, уполномоченные в соответствии с их профессиональной практикой, проводили медицинские обследования на инфекционные заболевания.
- Четко определите требования к одежде и гигиенические процедуры для персонала и посетителей в вашей письменной программе гигиены.
- Убедитесь, что сотрудники носят чистую одежду и защитные покрытия там, где существует вероятность заражения сырья, материалов в процессе производства или лекарств. Разработайте письменные процедуры, охватывающие основные требования к одежде (например, защитная одежда и покрытие для волос и бороды) для любого человека, входящего в производственные помещения.
- Вам могут потребоваться более строгие требования (например, маска, специальная обувь и одежда, обеспечивающая более высокий уровень защиты) для операторов, работающих с незащищенным продуктом.
- Убедитесь, что операторы избегают прямого контакта кожи с сырьем, первичными упаковочными материалами, оборудованием, лекарствами в процессе производства или лекарствами.
- Не допускайте антисанитарных практик (таких как курение, еда, питье и жевание) или позволяйте персоналу хранить растения, еду, напитки, курительные материалы или личные лекарства в производственных помещениях (или в любых других местах, где они могут отрицательно повлиять на качество продукции).
- Изложение требований к личной гигиене (с акцентом на гигиену рук). Убедитесь, что за ними следят сотрудники.
- Общие требования к косметике и украшениям, которые носят сотрудники. Убедитесь, что за ними следят сотрудники.
- Храните загрязненную защитную одежду (если она многоразовая) в отдельных контейнерах до тех пор, пока она не будет должным образом выстирана и (при необходимости) не продезинфицирована или стерилизована. Обеспечьте наличие формализованной процедуры стирки защитной одежды под контролем вашей компании.Стирка одежды в домашних условиях недопустима.
Испытание сырья
С.02.009
- Каждая партия или партия сырья должна быть проверена на соответствие спецификациям на сырье до ее использования в производстве лекарственного средства.
- Никакая партия или партия сырья не должна использоваться при изготовлении лекарственного средства, если эта партия или партия сырья не соответствует спецификациям для этого сырья.
- Невзирая на подраздел (1), вода может до завершения испытаний в соответствии с этим подразделом использоваться для изготовления лекарства.
- Если какое-либо свойство сырья может быть изменено при хранении, никакая партия или партия этого сырья не должна использоваться при изготовлении лекарственного средства после его хранения, если только сырье не будет повторно испытано после соответствующего интервала и не соответствует его спецификациям. для этой собственности.
- Если спецификации, указанные в подразделах (1), (2) и (4), не предписаны, они должны
- быть в письменной форме;
- будет приемлемым для Министра, который должен учитывать спецификации, содержащиеся в любой публикации, упомянутой в Приложении B к Закону Закона ; и №
- должен быть утвержден лицом, ответственным за отдел контроля качества.
Обоснование
Тестирование сырья перед его использованием преследует две цели:
- Подтвердите идентичность сырья.
- Подтвердите, что сырье обладает свойствами, которые обеспечат желаемое качество, количество или выход в данном производственном процессе.
Структура обеспечения качества: Рекомендации по спецификации
Структура обеспечения качества: Рекомендации по спецификацииАннотация
Цель этого документа — помочь редакторам W3C в написании более качественных спецификаций, облегчая интерпретацию спецификации без двусмысленности и делая более ясным то, что требуется для соответствия.Он фокусируется на том, как определить и указать соответствие. В нем также рассматривается, как спецификация может допускать вариации между соответствующими реализациями. В документе представлены рекомендации или требования, дополненные передовой практикой, примерами и методами.
Статус этого документа
В этом разделе описывается статус этого документа в то время его публикации. Другие документы могут заменять этот документ. А список текущих публикаций W3C и последняя редакция этого технический отчет можно найти в указателе технических отчетов W3C по адресу http: // www.w3.org/TR/.
Это документ W3C Рекомендация. Он был рассмотрен членами W3C и другими заинтересованными стороны и был одобрен Директором. Это стабильный документ и может использоваться в качестве справочного материала или цитироваться в качестве нормативной ссылки из другой документ. Роль W3C в создании Рекомендации заключается в привлечении внимание к спецификации и содействие ее широкому распространению. Этот увеличивает функциональность и совместимость Интернета.
Этот документ был разработан Рабочей группой по обеспечению качества в рамках деятельности по обеспечению качества.Английская версия данной спецификации является единственной нормативной версией. Возможны переводы этого документа.
Если у вас есть какие-либо комментарии к этому документу, отправьте их по адресу [email protected], по почте список с общедоступными архивами. Опечатка список для этого издания доступен.
В этот документ были внесены лишь незначительные редакционные исправления, поскольку он был опубликован как Предлагаемая рекомендация. Свидетельства взаимодействия по крайней мере между двумя реализациями этой спецификации задокументированы в отчете о реализации.
Страница раскрытия патентов Рабочей группы в соответствии с Патентом W3C Политика от 5 февраля 2004 г. содержит описания патентов, относящиеся к данной спецификации. Лицо, имеющее фактические знания о патенте, который, по его мнению, содержит основные пункты формулы (-ий) в отношении данной спецификации, должен раскрыть информацию в соответствии с разделом 6 Патентной политики W3C.
Содержание
Список требований:
Список передовых практик:
Приложение
1.Введение
1.1 Область применения
Этот документ представляет собой руководство для редакторов спецификаций W3C. Он содержит рекомендации по улучшению характеристик, связанных с соответствием. В этом отношении этот документ отличается от других документов, связанных с процессами W3C и публикациями. В нем рассматриваются самые основные и критические темы в отношении соответствия, включая то, как передать то, что требуется для реализации, чтобы соответствовать, и как разрешить вариации между соответствующими реализациями.
Термин спецификация используется в соответствии с определением в ISO Guide 2-4 [ISO-GUIDE] как означающий документ, который предписывает требования, которым должен соответствовать продукт, процесс или услуга. Спецификации могут быть определены в одном документе или в виде связного набора из нескольких документов (см. Спецификации Umbrella в Изменчивость в спецификациях [VIS] для более подробного обсуждения), а также могут импортировать требования других спецификаций с нормативными ссылками.
Помимо соответствия, есть несколько других тем, которые следует рассмотреть при написании спецификации, таких как доступность, интернационализация, безопасность и независимость от устройств.Эти темы не входят в объем этого документа, но упоминаются в разделе 3.3. Авторам и редакторам спецификаций предлагается рассмотреть эти темы и координировать свои усилия в этих областях с соответствующими рабочими группами W3C.
1.2 Цели и мотивация
Цель состоит в том, чтобы дать возможность рабочим группам создавать точные спецификации, которые легче интерпретировать, без двусмысленности или путаницы, а также более четкие в отношении того, что требуется для соответствия. Хорошие спецификации приводят к лучшим и более совместимым реализациям и способствуют разработке наборов тестов и инструментов.
Хорошо написанные спецификации выгодны каждому. У редакторов может быть меньше доработок и, следовательно, меньше проблем, возникающих во время разработки спецификации, и меньше ошибок после ее завершения. Разработчики могут внедрить раньше и иметь больше шансов соответствовать спецификации. Разработчики тестов могут делать однозначные утверждения теста. Конечные пользователи выигрывают от наличия совместимых решений. W3C выигрывает за счет более качественного выпуска рекомендаций и меньшего количества обслуживания.
1.3 Для чего нужны спецификации?
Написать точные, ясные, полные и непредвзятые спецификации — непростая задача. Это требует планирования, организации и дальновидности в отношении технологии, ее реализации и использования, а также того, как технические решения влияют на соответствие. Этот документ предоставляет набор требований, передовых практик, примеров и методов, которые помогут читателю принять решения, необходимые для написания точных требований, а также установления, определения и уточнения соответствия для спецификаций.
Редакторы и авторы заняты тем, что хотят опубликовать спецификацию, и уже имеют список для чтения документов W3C. Хорошее место для начала — Домашняя страница редактора W3C [EDITOR]. Этот документ можно использовать как контрольный список вещей, которые следует учитывать, как руководство с примерами и методами, которые могут быть адаптированы, и как справочник для понимания концепций соответствия и терминологии.
1.4 Аудитория этого документа
Основная аудитория этого документа — редакторы; тем не менее, это применимо к более широкой аудитории, включая:
- Тем, кто просматривает спецификации в процессе их разработки,
- Исполнители технических условий,
- Создатели тестовых материалов, включая комплекты и инструменты для тестирования на соответствие.
В этом документе не делается различий между терминами «редакторы» и «авторы», и они все вместе именуются «редакторами».
1.5 Об этом документе
Этот документ представляет собой практическое руководство по написанию спецификации, предлагающее редакторам темы для рассмотрения. Нормативное содержание содержится в небольшом количестве Требований и немного больше Надлежащих практик . Как объясняется в разделе о соответствии данной спецификации, Требования необходимы для заявления о соответствии Руководству по спецификации, а передовой опыт — это рекомендации, которые в дальнейшем улучшат качество спецификации.
Общая цель этих требований и передовых практик состоит в том, чтобы облегчить создание полного пункта о соответствии в каждой спецификации. Шаблон пункта соответствия [CONF-TEMPLATE] предоставлен для того, чтобы помочь редакторам удовлетворить требования этого документа и получить в итоге пункт соответствия. Обратите внимание, что для некоторых технических отчетов (например, The QA Handbook [QA-HANDBOOK], Architecture of World Wide Web, Volume One [WEB-ARCH]), где соответствие не является проблемой (например.g., без нормативного содержания) пункт о соответствии может быть объяснением того, почему нет «соответствия данному документу», и может быть представлен в другом разделе, а не в отдельном разделе соответствия.
Темы, представленные в данном документе, являются всеобъемлющими (самодостаточными) и предоставляют информацию, необходимую для понимания и успешного применения Требования или передовой практики, хотя могут быть ссылки на связанную информацию и дополнительные темы.
Если вы торопитесь, просто прочтите первый раздел руководящих указаний, Определение соответствия — это может быть все, что вам нужно прочитать, чтобы достичь ожидаемого результата соблюдения этого документа, т.е.е. указание соответствия. Он служит дорожной картой для других частей этого документа, которые помогают достичь соответствия.
1.5.1 Структура этого документа
Этот документ состоит из серии руководящих принципов, таких как Определение соответствия и Управление изменчивостью . Каждое из этих руководящих принципов представляет и объясняет требования и передовой опыт . Методики и Примеры сопровождают каждое Требование и Передовую практику.Эти методы иллюстрируют основные (и не исчерпывающие) вопросы или методы, помогающие реализовать Требование / передовую практику и составить текст спецификации. Примеры представляют собой объяснения или отрывки из существующих спецификаций W3C, которые конкретно иллюстрируют мысль, изложенную в Требовании / Передовой практике.
Пункт о соответствии этого документа описывает требования соответствия для заявления о соответствии данному Руководству по спецификации. Редактор спецификаций, желающий написать спецификацию, соответствующую Руководству по спецификациям, должен убедиться, что она удовлетворяет требованиям соответствия, указанным в разделе соответствия этого документа.
1.5.2 Другие рамочные документы по обеспечению качества
Этот документ полезен как отдельный документ или как часть семейства документов QA Framework, предназначенных для помощи рабочим группам в улучшении всех аспектов их методов обеспечения качества.
- QA Handbook [QA-HANDBOOK] — это ненормативный справочник о процессах и операционных аспектах практики качества рабочих групп W3C.
- Изменчивость в спецификациях моделирует, как проектные решения, влияющие на соответствие, изменяют ландшафт взаимодействия для спецификации.
- The Test Development F.A.Q. решает некоторые из обычных проблем, с которыми приходится иметь дело рабочим группам, когда они начинают разработку набора тестов для своих спецификаций.
- Различные страницы QA Wiki предоставляют информацию о разработке набора тестов.
2. Руководство
2.1 Определение соответствия
Соответствие — это выполнение определенных требований продуктом, процессом или услугой.Эти требования подробно описаны в спецификации как часть раздела о соответствии и в теле спецификации. Пункт соответствия — это раздел спецификации, который определяет все критерии, которые должны быть удовлетворены, чтобы заявить о соответствии спецификации.
Четкое представление соответствия имеет решающее значение для успешной совместимости реализаций. Модель соответствия и язык, используемый для нормативной информации, определяют тестируемость спецификации.Они также влияют на общий ландшафт реализации, начиная от узкого соответствия с несколькими допустимыми вариациями в реализациях до нескольких типов соответствия, что приводит к многочисленным вариациям в соответствующих реализациях. Модель должна быть выбрана тщательно, чтобы обеспечить предполагаемый диапазон реализации.
2.1.1 Пункт о соответствии является обязательным.
Пункт о хорошем соответствии является конечной целью данного руководства и санкционирован соответствием данной спецификации.
Пункт о соответствии спецификации — это высокоуровневое описание того, что требуется от реализаций. Это, в свою очередь, относится к другим частям спецификации за подробностями. В идеале читатели могут найти любую информацию, относящуюся к соответствию, в его пункте о соответствии, который служит корневым источником.
Для некоторых спецификаций модель соответствия может быть простой и понятной, а шаблон пункта соответствия [CONF-TEMPLATE] по завершении может предоставить большую часть информации, необходимой в пункте соответствия.Для других спецификаций, когда модель соответствия является сложной или запутанной, ссылки Advanced Topics (см. Изменчивость в Спецификациях [VIS]) могут быть неоценимыми.
Требование 1: Включите пункт о соответствии.
Что это значит? Положение о соответствии дает ответы на важные вопросы: что может соответствовать и как? Пункт о соответствии определяет на высоком уровне, что требуется от разработчиков спецификации.Это, в свою очередь, может относиться к другим частям спецификации или другим спецификациям. Пункт о соответствии может разделить технологию на функциональные подмножества, такие как профили, модули или другие структуры. Кроме того, он может указывать минимальные требования для определенных функций, а также расширяемость, дополнительные функции и альтернативные подходы, а также способы их обработки.
Почему это нужно? Пункт о соответствии определяет, что требуется для утверждения соответствия: как таковое, он обеспечивает связь между создателями спецификации, разработчиками и пользователями относительно того, что требуется, и придает смысл фразе «соответствующая реализация».«Более того, это способствует последовательному применению соответствия в рамках одной спецификации и между соответствующими спецификациями. Это способствует взаимодействию.
Методы
- Используйте шаблон для создания условия соответствия.
Просто заполните шаблон пункта о соответствии и поместите результат в спецификацию.
Честно говоря, ответ на вопросы в шаблоне пункта о соответствии может оказаться непростым делом и может привести Рабочую группу к сложным вопросам.Тем не менее, это вопросы, на которые необходимо ответить, если спецификация должна быть успешной, т. Е. Если она призвана способствовать множеству высококачественных взаимодействующих реализаций.
- Создайте элемент в содержании для раздела соответствия.
Если технология состоит из нескольких отдельных рекомендаций, создайте элемент оглавления для соответствия и объясните, что раздел соответствия находится в другом документе.
Примеры
Спецификация Ruby Annotation [RUBY] является примером краткой спецификации с подробным условием соответствия.
Спецификация SVG 1.0 [SVG11] содержит подробный пункт о соответствии для сложной модульной технологии.
Передовая практика 1: Определите модель соответствия спецификации в разделе соответствия.
Что это значит? Модель соответствия — это концептуальная структура, в которой определяется соответствие. Он состоит из следующих трех тем и определяется как минимум на их основе:
- Что и как должно соответствовать — в дальнейшем класс продукции .
- Любые специальные обозначения или концепции, используемые для различения категорий соответствия, типов и т. Д. (Например, профиль / модуль / уровень, правильно сформированный / действительный, A / AA / AAA).
- Способы, которыми соответствующие реализации могут отличаться друг от друга (например, возможности и расширения).
Почему это нужно? Главное — сообщить читателю, что такое соответствие спецификации. Модель обеспечивает основу для разработчиков, описывает, что им нужно построить, чтобы соответствовать, и объясняет различные способы, которыми они могут заявить о соответствии.Он предоставляет пользователям и клиентам основу для выражения своих требований.
Методы
- Перечислите классы продукции, указанные в спецификации.
- Укажите типы продуктов, которые будут соответствовать спецификации.
- Если это еще не сделано (шаг выше), сгруппируйте продукты в общие категории — это классы продуктов (например, контент, пользовательский агент, протокол, API, спецификация).
- Перечислите обозначения соответствия или концепции соответствия.Чтобы понять это, рассмотрите эти вопросы.
- Означает ли соответствие что-то разное для разных классов продуктов?
- Определено более одного типа соответствия — например, разные обозначения (правильно оформленные, действительные) или степени соответствия (A, AA, AAA)?
- Привязано ли соответствие к классу продуктов и имеет одноименное название (например, соответствие языку хоста, соответствие документа)?
- Создайте имя для каждого способа определения соответствия — i.е., обозначьте это.
- Для спецификаций, разделенных на модули, профили и / или уровни, есть ли обозначение соответствия, связанное с каждым типом подразделения?
- Если в спецификации есть опции и возможности расширения, повлияют ли они или будут затронуты обозначением соответствия?
- Нарисуйте диаграмму, чтобы собрать все воедино — иногда проще работать по картинке.
- Схема классов продуктов с соответствующими обозначениями соответствия.
- Добавьте подразделения и любую другую вариативность (например, опции, расширяемость).
- Извлеките из этой диаграммы и определите модель соответствия.
- Впишите описание в спецификацию. Бонус — если диаграмма помогает понять модель, включайте ее.
Рисунок 1: Модель соответствия спецификации Ruby
Спецификация Ruby Annotation [RUBY] определяет два типа соответствия, привязанных к моделям содержимого: простое и полное.Спецификация определяет шесть типов продуктов, которые мы можем сгруппировать в три класса продуктов (контент, спецификация, пользовательский агент). Для каждого из них в разделе соответствия определены требования для выполнения простого или полного соответствия.
Примеры
XML 1.0 [XML10] имеет два класса продуктов (документ и процессор). Каждый из них имеет две степени соответствия (правильно сформированный / действительный и подтверждающий / не подтверждающий). xml: base , пространства имен XML и XLink также можно рассматривать как «модули» для XML, даже если они формально не определены как таковые.
SVG 1.1 [SVG11] имеет примерно четыре класса продуктов (фрагменты разметки с разной степенью, генераторы, интерпретаторы и средства просмотра). Некоторые из этих классов продуктов имеют различные степени соответствия (Приложение G: Критерии соответствия [SVG11]), например, статический / динамический для интерпретаторов и статический / динамический для высокого качества для зрителей. SVG 1.1 также определяет модули, которые сгруппированы в профили (крошечные / мобильные / полные).
Передовая практика 2: Укажите в пункте о соответствии, как отличить нормативное содержание от информационного.
Что это значит? Нормативное содержание является предписывающей частью спецификации, тогда как информативное содержание предназначено для информационных целей и помогает в понимании и использовании спецификации. Контент включает всевозможные формы — не только описательную прозу, но также иллюстрации, примеры, варианты использования, формулы и другие формализмы.
Почему это нужно? Соответствие реализаций определяется и измеряется нормативным содержанием. Отличие нормативного содержания от информативного помогает убедиться, что читатель может найти нормативное содержание, точно знает, что оно является нормативным, и не может не заметить нормативный раздел.Эта передовая практика направлена на разделение информации на высоком уровне (например, на разделы) в спецификации.
Методы
- По каждому разделу в спецификации:
- Определите, является ли контент нормативным или информативным, и четко обозначьте его как «нормативный» или «информативный».
- Сделайте метку частью заголовка раздела (например, справочные ссылки) в виде текста в скобках с заголовком, например, «Глоссарий (нормативный)».
- В качестве альтернативы создайте список всех разделов и укажите их нормативность (например, ).g., «Нормативные части в разделе о соответствии этого документа»).
- В пункте о соответствии объясните, какое использование и значение (при необходимости) слов используются для передачи нормальности и неформальности содержания. См. Требование 7. Используйте единый стиль для соответствия требованиям и объясните, как их различать.
- Старайтесь избегать формулировок, которые звучат нормативно в информативном разделе. Это может привести читателей к неверным предположениям.
2.1.2 Укажите, как делать заявления о соответствии.
Центральное сообщение этого раздела — «имейте пункт о хорошем соответствии» — содержит множество дополнительных деталей. Поскольку пункт о соответствии является основой для определения и измерения соответствия, он также является основой для оценки заявлений о соответствии. Одна деталь, заслуживающая внимания, — это «заявления о соответствии».
Вместо того, чтобы жить с бесконечным разнообразием заявлений о творческом соответствии, которые могут возникнуть в вакууме, спецификация может быть проактивной.
Передовая практика 3: Приведите формулировку заявлений о соответствии.
Что это значит? Люди (например, продавцы, покупатели) неизбежно будут заявлять о соответствии или требовать соответствия технологии. Фактически, в определенных ситуациях может потребоваться заявить о соответствии технологии. Таким образом, важно обеспечить последовательный и недвусмысленный способ заявить об этом. Идентификация версии спецификации, класса продукции и этикетки соответствия — вот некоторые из пунктов, которые могут быть частью такой формулировки.
Почему это нужно? Наличие структуры, с помощью которой можно делать заявления о соответствии для конкретного использования технологии, сводит к минимуму путаницу среди людей, заинтересованных в таких заявлениях. Во многих контекстах используются утверждения о соответствии, в том числе юридические как часть нормативных актов, законов или политик, а также коммерческие при продаже или покупке продукта.
Методы
- Предоставьте образец заявления о соответствии, включая:
- Полное название спецификации вместе с информацией для ее уникальной идентификации — версия, дата и URI, если применимо.
- Заполнители для:
- Обозначение соответствия — этикетка или тип заявленного соответствия.
- Товар с заявлением о соответствии информации для однозначной идентификации — версия, дата.
- Дата предъявления претензии. Заявление о соответствии реализации
- (если таковое существует, см. Следующий пример передовой практики).
Шаблон заявления о соответствии:
Форма 1:
- Название спецификации, дата и версия: Спецификация Foo, версия 1.0, 29 февраля 2003 г .:
- URI спецификации: http://www.example.org/TR/2003/FOO-20032902
- Завершено ICS URI: http://mycompany.example.com/ICS-20032902
- Обозначение соответствия выполнено: «соответствующий процессор»
- Название продукта: My_Processor, версия 1.2, 1 января 2004 г.
- Дата предъявления претензии: 1 апреля 2004 года
Форма 2:
1 апреля 2004 г. My_Processor, версия 1.2, 1 января 2004 г., заявляет о соответствии как «соответствующий процессор» Спецификации 1 FOO.0, 29 февраля 2003 г., доступно по адресу http://www.example.org/TR/2003/FOO-20032902
Примеры
WCAG 1.0 [WCAG10] — хороший пример спецификации, объясняющей, как сделать заявление о соответствии в зависимости от степени соответствия.
Передовая практика 4: Предоставьте форму Заявления о соответствии реализации.
Что это значит? Заявление о соответствии реализации (ICS) предоставляет информацию о реализации спецификации путем единообразного представления реализованных возможностей (например,g., функции, особенности) и опции, а также ограничения реализации. Форма ICS обычно принимает форму пустого вопросника или контрольного списка для реализации. Он предоставляет разработчику способ указать реализованные функции. Думайте об этом как о перечне того, что было реализовано. Обратите внимание, что завершенный ICS не указывает на соответствие реализации. Следовательно, ответ «да», указывающий на то, что возможность поддерживается, не означает, что эта возможность была протестирована.
Эта передовая практика предполагает, что сама спецификация должна включать проформу ICS. Предоставление проформы ICS способствует завершению отчета и помогает обеспечить согласованность между завершенными ICS.
Почему это нужно? Форма ICS предоставляет краткое изложение спецификации, то есть возможностей и опций, определенных в спецификации, а также любых определенных подразделов (например, профилей, модулей) и обозначений соответствия. ICS, поставляемый со спецификацией, пуст, ожидает завершения разработчика.Эта пустая ICS предоставляет разработчикам и пользователям быстрый обзор функций, определенных в спецификации. Завершенная ICS не только предоставляет информацию о том, что было реализовано (обязательные и дополнительные функции), но также может использоваться для документирования наличия расширений или любых сделанных специализаций. Заполненная ICS предоставляет информацию, полезную для облегчения выбора подходящих тестов для конкретной реализации. Однако это еще не все. Хотя содержимое ICS не зависит от тестирования, его связь с тестами на соответствие делает его важным элементом в отчетности о результатах соответствия (см. Методы в Передовой практике 5).
Методы
- Создайте список, таблицу или форму, в которой перечисляются все функции (возможности) и указываются, какие из них необходимо реализовать.
- Предоставьте разработчику место для проверки: «Да» (чтобы указать, что функция реализована), «Нет» (чтобы указать, что она не реализована), «Не применимо» и место для комментариев.
- Организуйте функции в соответствии с подразделами спецификации или в том порядке, в котором они встречаются в спецификации или в какой-либо другой логической группировке.
- Если есть зависимости, укажите их. (Например, «Если вы ответили« Нет »на этот вопрос, переходите к следующему разделу»).
- Предоставьте инструмент, который поможет разработчикам заполнить ICS и создать отчет (например, в EARL [EARL]).
Примеры
Руководство по спецификации QA предоставляет ICS [QA-SPEC-ICS], чтобы помочь разработчикам оценить соответствие этому документу. Передовой опыт (информативный) и Требования (нормативный) приведены в таблице, где исполнители могут отметить «Да», «Нет» или «Не применимо» и добавить комментарии.
Передовая практика 5: Требовать Заявление о соответствии реализации как часть заявлений о соответствии.
Что это значит? Передовая практика 5 просто объединяет две предыдущие передовые практики. Спецификация не только может предоставить проформу ICS для разработчиков, но также может потребовать ссылку на проформу ICS из стандартного шаблона заявления о соответствии.
Почему это нужно? Предоставление завершенной ICS с заявлением о соответствии может помочь клиентам и пользователям быстро определить реализованные возможности, а также легко проверить уровень поддержки индивидуальных требований спецификаций.Сочетание ICS с набором тестов на соответствие может укрепить претензии. В частности, ICS, дополненная ссылками на тесты на соответствие, предоставляет очень хороший способ указать не только то, что было реализовано, но также и то, что было реализовано правильно (то есть соответствует спецификации).
Методы
- Дайте точные инструкции о том, как ICS становится частью заявления о соответствии. ICS может быть внешним документом, или спецификация может ссылаться на документ с точной датой и т. Д.
- Дополните ICS, предоставив ссылки на набор тестов, чтобы с каждой функцией был связан тест (или набор тестов). Объясните, что означает отметка «Да» или «Нет». В частности, указывает ли Да / Нет на то, что реализация имеет соответствующую функцию и проходит соответствующие тесты, или Да / Нет указывает только на то, что функция реализована. В последнем случае, во избежание недоразумений, рекомендуем добавить дополнительный столбец для отображения результатов выполнения тестов.
Примеры
Спецификация WebCGM требует наличия ICS как части заявления о соответствии. Контрольный список WebCGM описывает соответствие продукта предметной программы просмотра спецификации WebCGM в соответствии с его характеристиками в наборе тестов WebCGM.
2.2 Установка основных правил
2.2.1 Область применения
Путь к спецификации качества начинается с ее объема. Очень важно передать суть спецификации, описав ее назначение и применимость.По мере развития спецификации рекомендуется пересматривать область действия, чтобы убедиться, что она по-прежнему отражает намерение спецификации или нуждается в изменении.
Требование 2: Определите объем.
Что это значит? Опишите, о чем идет речь. Расскажите читателю о темах, затронутых в спецификации.
Почему это нужно? Область видимости — один из первых разделов, которые читает читатель, поэтому важно привлечь их внимание и убедиться, что они понимают, о чем идет речь в спецификации.Это помогает сфокусировать содержание спецификации. Это помогает рецензентам определить, когда спецификация выходит за рамки своего мандата, и дает возможность пересмотреть спецификацию, пока она находится в разработке. Это также помогает читателям узнать пределы или границы спецификации и интересует ли она их.
Методы
- Сделайте так, чтобы прицел было легко найти.
- Включите раздел области в начало документа.
- Сделайте «Область действия» элементом в оглавлении.
- Напишите простые, прямые утверждения о фактах. Не включайте никаких требований в раздел области применения. Используйте такие утверждения, как «Этот документ»:
- — указывает метод….
- — указывает характеристики….
- — определяет….
- — устанавливает систему для….
- — устанавливает общие принципы для….
- — это руководство для….
- В дополнение к описанию предмета спецификации, обратитесь к следующему, чтобы достичь более полного объема:
- Применимость спецификации
- Цель, задачи и задачи
- Типы продуктов или услуг (т.е., классы продуктов), к которым применяется спецификация
- Связь с другими спецификациями или технологиями
- Что не входит в сферу применения, т.е. о чем не говорится в спецификации
- Ограничения по применению спецификации.
Примеры
Многие спецификации W3C включают описание области действия в раздел «Аннотация».Мы выступаем за выделение области действия в отдельный раздел в основной части спецификации, чтобы упростить поиск и обеспечить, чтобы это был элемент в оглавлении.
Могло быть лучше :
- Язык математической разметки (MathML), версия 2.0 (второе издание) [MATHML20] — Введение, хотя и очень обширное и полное, не дает быстрого представления о том, что такое MathML. Реферат намного лучше дает краткое описание области действия Рекомендации.
- WCAG 1.0 [WCAG10] содержит обширное и полное введение, но без области применения. Аннотация дает очень прямое заявление о сфере применения Руководства.
Передовая практика 6: Приведите примеры, варианты использования и графику.
Что это значит? Проиллюстрируйте концепции, поведение, функциональность, взаимодействие и т. Д. С помощью любых разумных средств, например примеров, вариантов использования, графики и образцов кода. Они помогают понять спецификацию, особенно области, которые изначально сложны или которые Рабочей группе пришлось объяснять членам W3C или общественности.Кроме того, набор общих примеров и вариантов использования может помочь уточнить объем спецификации.
Почему это нужно? Трудно понять некоторые концепции, поведение, функциональные возможности или другие аспекты спецификации без информативных интерпретаций, которые помогут читателю. Предоставление читателю дополнительной информации, выходящей за рамки спецификации, может только помочь в достижении реализации и взаимодействия.
Методы
Рабочая группа должна определить лучший способ иллюстрировать область применения и другие части спецификации.Обычно характер спецификации влияет на тип примеров, вариантов использования, графики и т. Д., Которые имеют смысл.
- Разработайте варианты использования, чтобы проиллюстрировать объем спецификации. Используйте легкое для понимания повествование, чтобы описать ситуации, применимые к спецификации.
- Приведите примеры:
- За каждое поведение или функцию, устраненную в результате проблемы.
- Для иллюстрации значения абстрактных обозначений (например, BNF).
- Для каждой главы в спецификации.
- Опишите особенности технологии на многочисленных примерах и дополните их ссылками на нормативные тексты.
- Ссылка на ненормативный учебный документ, который включает информативное объяснение концепций, поведения или функций.
- Обеспечьте ненормативные ссылки на ресурсы, такие как книги, аннотации спецификаций, наборы тестов. Эти ссылки содержат аннотации к спецификации, графические иллюстрации и объяснения правил спецификации.
Примеры
Для спецификаций разметки предоставьте по крайней мере один пример каждой конструкции разметки; проиллюстрируйте каждую возможность преобразования на примере ввода и вывода.
SVG 1.1 [SVG11]: для каждого элемента спецификации SVG есть подробное определение элемента, определение DTD, определения атрибутов и пример. Например, в определении элемента rect есть точные примеры с разметкой, необходимой для создания прямоугольника, рендеринг разметки в виде изображения, чтобы помочь людям визуализировать его, и отдельный файл с указанной разметкой.
HTML 4.01 [HTML401]: Спецификация HTML 4.01, разработанная очень познавательно, содержит несколько очень хороших примеров.
Передовая практика 7. Напишите пример кода или тестов.
Что это значит? Для каждой функции рабочая группа может стремиться к скорейшей реализации, чтобы продемонстрировать эту функцию. Если ранние реализации недоступны (например, из-за коммерческих ограничений, IPR и т. Д.), Полезно написать тестовые примеры для иллюстрации концепции или варианта использования технологии.Это дает возможность изучить взаимодействие между различными частями спецификации и выявить проблемы. Кроме того, эти тестовые примеры могут быть включены в набор тестов.
Почему это нужно? Разработка частичной реализации (пример кода) или тестовых примеров может обеспечить понимание концепции или функции, а также помочь сохранить фокус на концепции или функции. Частичная реализация (пример кода) или тестовые примеры могут сэкономить рабочую группу и, в конечном итоге, реализовать время и ресурсы:
- Примеры для иллюстрации спецификации.
- Содействие разрешению проблем.
- Помогает иметь предварительный отчет о внедрении на уровне зрелости кандидата в рекомендации.
- Участвовал в разработке полного набора тестов.
- Поощрение внешних внедрений и, следовательно, более полный отчет о реализации.
Методы
- Поощрять разработку доказательств концепция реализации технологии.
- Приведите хотя бы один пример каждой функции, который также может быть использован в качестве основы для будущего тестового примера.
- Не включайте функцию в спецификацию без соответствующих тестовых примеров.
- Создайте шаблон для предложений новых функций, который включает запрос связанных тестовых случаев.
Примеры
Рабочая группа OWL синхронизировала публикацию своей спецификации и публикацию тестовых примеров OWL [OWL-TEST]. Они даже пошли немного дальше, сделав тестовый пример необходимым шагом для разработки функции с ее требованиями.
2.2.2 Что нужно согласовывать?
Требование 3: Определите, кто и / или что будет выполнять спецификацию.
Что это значит? Четко определите класс продуктов (т. Е. Тип продуктов или услуг), к которому предъявляются требования. Если спецификация нацелена на несколько классов продуктов, убедитесь, что каждый из них описан. Примеры классов продуктов включают в себя: контент, производителя контента, проигрыватель, протокол, API, агент и инструкции.
Почему это нужно? Класс продуктов помогает определить объем спецификации и необходим при определении соответствия. Это также помогает читателю узнать цель спецификации — то есть обнаружить и сосредоточиться на том, для чего они обратились к документу, и избежать того, что они могут найти несущественным.
Методы
- Укажите классы продукции в спецификации:
- Подумайте обо всех типах продуктов или услуг, которые будут реализовывать эту технологию, сгруппируйте те, которые похожи или служат для достижения той же цели, и определите общее название для группы.Эти группы представляют собой классы продуктов.
- Перечислите эти классы продуктов в спецификации.
- Опишите их как часть объема работ.
Примеры
Раздел соответствия Ruby [RUBY] очень подробен и подробно описывает классы продуктов. Для каждого из этих классов соответствие Ruby раздел определяет набор правил, которые должны уважение. Ruby определяет правила для разметки, DTD, документа, модуля, генератора, и переводчик.
2.2.3 Нормативные (и ненормативные) ссылки
Спецификация, редко написанная изолированно, наследует от ранее определенных технологий. Это также может определить будущее других спецификаций, определив их основу. Таким образом, важно четко определить характер ссылок на предыдущие спецификации (нормативные или информативные) и значение этих ссылок для будущего технологии.
Требование 4: Составьте список нормативных ссылок.
Что это значит? Спецификация редко разрабатывается с нуля: обычно она опирается на другие технологии, определенные в других спецификациях. Рабочая группа должна определить любые спецификации, которые определяют основные технологии разрабатываемой технологии.
Почему это нужно? Для Рабочей группы нормативные ссылки приносят немедленную пользу: «Не изобретайте велосипед». Использование функций, уже определенных в других документах, помогает минимизировать размер спецификации и избежать двусмысленности, переписывая те же концепции.
Знание о том, что часть спецификации основана на другой технологии, является огромным преимуществом для разработчиков, поскольку это разъясняет последствия для соответствия. Нормативные ссылки могут помочь разработчикам минимизировать свою работу за счет использования совместимых библиотек, уже реализованных в другом месте.
В более общем плане нормативные ссылки могут помочь читателям понять, откуда взялась технология и, следовательно, как использовать ее в сочетании с другими технологиями, которые они, возможно, уже знают.
Примеры
Спецификация
Этот документ описывает версию 3.15.x протокола языкового сервера. Реализацию для узла версии протокола 3.15.x можно найти здесь.
Примечание: изменений в этой спецификации могут быть сделаны с помощью запроса на вытягивание в отношении этого документа Markdown.
Все новые функции 3.15 помечены соответствующим текстом, начиная с версии 3.15, или в JSDoc с использованием аннотации @since 3.15.0 .Основные новые функции:
Базовый протокол состоит из заголовка и части содержимого (сравнимо с HTTP). Заголовок и контентная часть разделенные «\ r \ n».
Заголовочная часть состоит из полей заголовка. Каждое поле заголовка состоит из имени и значения, разделенных «:» (двоеточием и пробелом). Структура полей заголовка соответствует семантике HTTP. Каждое поле заголовка заканчивается символом «\ r \ n». Учитывая, что последнее поле заголовка и сам общий заголовок оканчиваются на ‘\ r \ n’, и что хотя бы один заголовок является обязательным, это означает, что две последовательности ‘\ r \ n’ всегда непосредственно предшествуют части содержимого сообщения. .
В настоящее время поддерживаются следующие поля заголовка:
| Имя поля заголовка | Тип значения | Описание |
|---|---|---|
| Длина содержимого | номер | Длина части содержимого в байтах. Этот заголовок обязателен. |
| Content-Type | строка | Тип пантомимы части содержимого. По умолчанию application / vscode-jsonrpc; charset = utf-8 |
Часть заголовка кодируется с использованием кодировки «ascii».Сюда входит «\ r \ n», разделяющий заголовок и часть содержимого.
Часть содержимого
Содержит фактическое содержание сообщения. Содержательная часть сообщения использует JSON-RPC для описания запросов, ответов и уведомлений. Часть содержимого кодируется с использованием кодировки, указанной в поле Content-Type. По умолчанию используется utf-8 , единственная поддерживаемая на данный момент кодировка. Если сервер или клиент получает заголовок wi
Образец спецификации пищевых продуктов Скачать бесплатно для Windows
Sonic Network, Inc.30 Коммерческий
Это программный сэмплер, разработанный специально для продюсеров хип-хопа.
TRH Software, Inc. 1 Условно-бесплатное ПО
Это программа, предназначенная для помощи в процессе маркировки пищевых продуктов.
43 Уильям Д. Дюпон и Уолтон Д. Пламмер-младший.1,940 Бесплатное ПО
Это статистическая программа для вычисления мощности и размера выборки.
25 Влодзимеж Грабовски 1,142 Демо
Предварительный просмотр, редактирование и преобразование аудиосэмплов с помощью одного инструмента.
Бесплатные образцы Канада Бесплатное ПО
FreeSamplesCanada — источник номер 1 бесплатных канадских образцов товаров для здоровья.
АппДев Продактс, ООО 11 Коммерческий
Это позволит профессионалам в области технологий с небольшим опытом работы с ETL или без него.
ProjectMatrix Условно-бесплатное ПО
Мощный пакет спецификаций контрактной мебели.
TestKing Условно-бесплатное ПО
Используйте примеры вопросов EX0-101 для доступа к качеству продукции.
TestKing Условно-бесплатное ПО
Используйте TestKing JN0-350 Примеры вопросов для доступа к качеству продукции.
Freedom Scientific 1 Бесплатное ПО
Mandarin — образец голоса, настроенный с помощью продукта Freedom Scientific.
Интерграф 65 Бесплатное ПО
Пользователи могут редактировать спецификацию с одним тегом или спецификацию с несколькими тегами.
NinjaLab Studios 2 Условно-бесплатное ПО
Food Logic — веселая, простая в освоении игра-головоломка. Помогите Джимми съесть вкусные лакомства, заменив еду креа ….
Ник Уилсон и Джонатан Уилсон 2 Бесплатное ПО
Подсчитайте стоимость еды в баллах по этикеткам на пищевых продуктах.
1 CalorieKing Wellness Solutions, Inc.Условно-бесплатное ПО
— это мощный дневник питания и упражнений в сочетании с крупнейшей базой данных о питании.
Институт ресторанного маркетинга 29 Бесплатное ПО
Food Cost Studio — бесплатная программа для расчета стоимости еды.
Звуковое пятно Демо
SampliCut предназначен для извлечения / преобразования проб на CD.
.
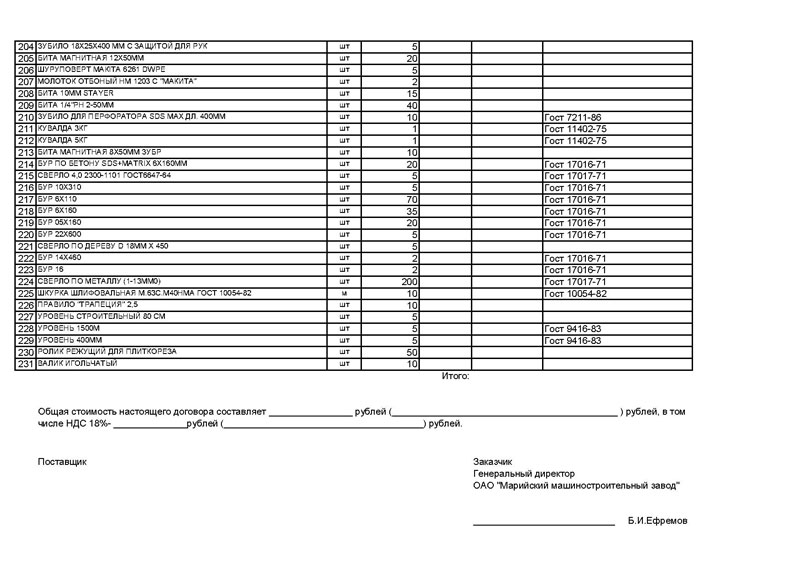
Об авторе