Виды фармацевтических лицензий: Виды фармацевтических лицензий \ Акты, образцы, формы, договоры \ КонсультантПлюс
Лицензирование фармацевтической деятельности и видов деятельности, связанных с оборотом наркотических средств, психотропных веществ и их прекурсоров
Авторы: Кононова С. В., Чеснокова Н. Н., Баранов Д. Е., Аношкина Е. В.
Введение.
Фармацевтическая деятельность в большинстве стран относится к наиболее регулируемым государством видам деятельности. Государственные органы власти активно воздействуют на фармацевтический рынок через целевые закупки продукции, оплату работ и услуг из средств бюджетов различных уровней, установление ограничений списков лекарственных средств для определенных категорий населения, прямое или косвенное влияние цены, а также регулируют деятельность через механизм лицензирования. Система лицензирования дает единственно эффективную возможность воздействия на фармацевтическую организацию (ФО). Деятельность органов лицензирования оказывает не только стимулирующее и дисциплинирующее влияние на работу лицензиатов, но и нацеливает их на постоянное повышение уровня профессиональной деятельности как государственных, так и частных ФО.
Следует отметить, что в рыночных условиях фармацевтическая деятельность усложняется. Это связано с финансово-хозяйственной деятельностью как отдельных аптечных организаций, так и аптечных сетей, наличием различных форм собственности – государственной, муниципальной, частной. В связи с этим потребность государственного регулирования видов деятельности в сфере обращения лекарственных средств не только не снижается, но и значительно возрастает. Это обусловлено изменением всей правовой базы деятельности субъектов лекарственного бизнеса и гармонизацией ее с международными нормами регулирования деятельности на фармацевтическом рынке.
Практика деятельности лицензирующих органов показала, что функционирует достаточно стройная, жизнеспособная государственная система, которая обеспечивает в пределах своей компетенции выполнение конституционных прав граждан на получение качественной, безопасной лекарственной помощи в необходимом объеме.
Вопросы, затрагиваемые в пособии, направлены на приобретение знаний в области основ процесса лицензирования фармацевтической деятельности, а также деятельности по обороту наркотических средств и психотропных веществ. Изучение этих вопросов позволит решать задачи по оказанию квалифицированной современной качественной фармацевтической помощи, даст основу для успешного управления фармацевтической организацией.
Изучение этих вопросов позволит решать задачи по оказанию квалифицированной современной качественной фармацевтической помощи, даст основу для успешного управления фармацевтической организацией.
1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПРОЦЕССА ЛИЦЕНЗИРОВАНИЯ
1.1. Нормативно-правовая база лицензирования фармацевтической деятельности
Основные нормативно-правовые документы, регламентирующие процедуры госконтроля и надзора.
1. ФЗ от 04.05.2011 г. № 99-ФЗ «О лицензировании отдельных видов деятельности»
2. ФЗ от 12.04.2010 г. № 61-ФЗ «Об обращении лекарственных средств»
3. ФЗ от 08.01.1998 г. № 3-ФЗ «О наркотических средствах и психотропных веществах»
4. ФЗ от 26.12.2008 г. № 294-ФЗ «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля»
5. Постановление Правительства РФ от 21.11.2011 № 957 «Об организации лицензирования отдельных видов деятельности»
6. Постановление Правительства РФ от 30.03.1998 г. № 681 «Об утверждении перечня наркотических средств и их прекурсоров, подлежащих контролю в Российской Федерации»
Постановление Правительства РФ от 30.03.1998 г. № 681 «Об утверждении перечня наркотических средств и их прекурсоров, подлежащих контролю в Российской Федерации»
7. Постановление Правительства РФ от 22.12.2011 г. № 1081 «О лицензировании фармацевтической деятельности»
8. Постановление Правительства РФ от 30.06.2004 г. № 323 «об утверждении Положения о Федеральной службе по надзору в сфере здравоохранения»
9. Постановление Правительства РФ от 22.12.2011 г. № 1085 «О лицензировании деятельности по обороту наркотических средств, психотропных веществ и их прекурсров, культивированию наркосодержащих растений»
10. Постановление Правительства РФ от 12.06.2008 г. № 449 «О порядке перевозки НС, ПВ и их прекурсоров на территории РФ, а также оформления необходимых для этого документов»
11. Постановление Правительства РФ от 16.04.2012 г. № 291 «О лицензировании медицинской деятельности (за исключением указанной деятельности, осуществляемой медицинскими организациями и другими организациями, входящими в частную систему здравоохранения, на территории инновационного центра «Сколково»)»
12. Постановление Правительства РФ от 09.06.2010 № 419 «О предоставлении сведений о деятельности, связанной с оборотом прекурсоров НС и ПВ, и регистрации операций, связанных с их оборотом»
Постановление Правительства РФ от 09.06.2010 № 419 «О предоставлении сведений о деятельности, связанной с оборотом прекурсоров НС и ПВ, и регистрации операций, связанных с их оборотом»
13. Постановление Правительства РФ от 03.09.2010 г. № 674 «Об утверждении Правил уничтожения лекарственных средств, фальсифицированных лекарственных средств и контрафактных лекарственных средств»
14. Постановление Правительства РФ от 18.08.2010 г. № 640 «Об утверждении правил производства, переработки, хранения, реализации, приобретения, использования, перевозки и уничтожения прекурсоров НС и ПВ»
15. Постановление Правительства РФ от 06.08.1998 г. № 892 «Об утверждении Правил допуска лиц к работе с НС и ПВ, а также к деятельности, связанной с оборотом прекурсоров НС и ПВ»
16. Постановление Правительства РФ от 20.07.2011 г. № 599 «О мерах контроля в отношении препаратов, которые содержат малые количества НС, ПВ и их прекурсоров, включенных в перечень НС, ПВ и их прекурсоров, подлежащих контролю в РФ.
17. Указ Губернатора Нижегородской области от 27.03.2012 № 19 «Об утверждении административных регламентов предоставления министерством здравоохранения Нижегородской области государственных услуг по лицензированию отдельных видов деятельности»
18. Приказ МЗ РФ от 13.12.2012 г. № 1040н «Об утверждении Положения о территориальном органе Федеральной службы по надзору в сфере здравоохранения»
19. Приказ МЗ РФ от 25.03.2014 г. № 130н «Об утверждении административного регламента Федеральной службы по надзору в сфере здравоохранения по представлению государственной услуги по лицензированию фармацевтической деятельности, осуществляемой организациями оптовой торговли лекарственными средствами для медицинского применения и аптечными организациями, подведомственными федеральным органам исполнительной власти, государственным академиям наук»
20. Приказ Министерства здравоохранения и социального развития России от 16.03.2010 г. № 157н «Об утверждении предельно допустимого количества НС, ПВ и их прекурсора, содержащегося в препаратах»
21. Приказ Росздравнадзора от 15.02.2012 г. № 547-Пр/12 «Об утверждении форм документов, используемых Федеральной службой по надзору в сфере здравоохранения в процессе лицензирования фармацевтической деятельности»
Приказ Росздравнадзора от 15.02.2012 г. № 547-Пр/12 «Об утверждении форм документов, используемых Федеральной службой по надзору в сфере здравоохранения в процессе лицензирования фармацевтической деятельности»
22. Приказ Росздравнадзора от 28.11.2006 г. № 2549-Пр/06 «Об утверждении форм документов, используемых Росздравнадзором в процессе лицензирования деятельности, связанной с оборотом наркотических средств и психотропных веществ, внесенных в Список II»
23. Приказ Министерства здравоохранения и социального развития и Федеральной службы по надзору в сфере здравоохранения и социального развития от 09.10.2006 г. № 2284-Пр/06 «Об утверждении форм документов, используемых Росздравнадзором в процессе лицензирования фармацевтической деятельности»
24. Письмо Росздравнадзора от 26 октября 2011 г. № 04И-1000/11 «О лицензировании»
25. Письмо Министерства здравоохранения и социального развития РФ от 3 февраля 2012 г. № 25-1/10/2-855
26. Письмо Министерства здравоохранения и социального развития РФ от 06. 06.2012 г. № 975/25-1 «О порядке отпуска кодеинсодержащих лекарственных препаратов»
06.2012 г. № 975/25-1 «О порядке отпуска кодеинсодержащих лекарственных препаратов»
27. Письмо Министерства здравоохранения РФ от 13.0.2014 № 25-4/10/2-79
28. Письмо Министерства здравоохранения и социального развития РФ № 25-1/10/2-1208 от 8 февраля 2011 г. (разъяснение о хранении ЛС).
1.2. Основные понятия, принципы процесса лицензирования
Федеральный закон от 4 мая 2011 № 99-ФЗ «О лицензировании отдельных видов деятельности» устанавливает правовые основы государственной политики и регулирует отношения, возникающие между федеральными органами исполнительной власти, органами исполнительной власти субъектов Российской Федерации, юридическими лицами и индивидуальными предпринимателями в связи с осуществлением лицензирования отдельных видов деятельности.
Основные понятия
Статья 3 Федерального закона от 04.05.2014 № 99-ФЗ дает определение следующим понятиям:
лицензирование – деятельность лицензирующих органов по предоставлению, переоформлению лицензий, продлению срока действия лицензий в случае, если ограничение срока действия лицензий предусмотрено федеральными законами, осуществлению лицензионного контроля, приостановлению, возобновлению, прекращению действия и аннулированию лицензий, формированию и ведению реестра лицензий, формированию государственного информационного ресурса, а также по предоставлению в установленном порядке информации по вопросам лицензирования;
лицензия – специальное разрешение на право осуществления юридическим лицом или индивидуальным предпринимателем конкретного вида деятельности (выполнения работ, оказания услуг, составляющих лицензируемый вид деятельности), которое подтверждается документом, выданным лицензирующим органом на бумажном носителе или в форме электронного документа, подписанного электронной подписью, в случае, если в заявлении о предоставлении лицензии указывалось на необходимость выдачи такого документа в форме электронного документа;
лицензируемый вид деятельности – вид деятельности, на осуществление которого на территории Российской Федерации и на иных территориях, над которыми Российская Федерация осуществляет юрисдикцию в соответствии с законодательством Российской Федерации и нормами международного права, требуется получение лицензии;
лицензирующие органы – уполномоченные федеральные органы исполнительной власти и (или) их территориальные органы, а в случае передачи осуществления полномочий Российской Федерации в области лицензирования органам государственной власти субъектов Российской Федерации органы исполнительной власти субъектов Российской Федерации, осуществляющие лицензирование;
соискатель лицензии – юридическое лицо или индивидуальный предприниматель, обратившиеся в лицензирующий орган с заявлением о предоставлении лицензии;
лицензиат – юридическое лицо или индивидуальный предприниматель, имеющие лицензию;
лицензионные требования – совокупность требований, которые установлены положениями о лицензировании конкретных видов деятельности, основаны на соответствующих требованиях законодательства Российской Федерации и направлены на обеспечение достижения целей лицензирования;
место осуществления отдельного вида деятельности, подлежащего лицензированию (место осуществления лицензируемого вида деятельности), — объект (помещение, здание, сооружение, иной объект), который предназначен для осуществления лицензируемого вида деятельности и (или) используется при его осуществлении, соответствует лицензионным требованиям, принадлежит соискателю лицензии или лицензиату на праве собственности либо ином законном основании, имеет почтовый адрес или другие позволяющие идентифицировать объект данные. Место осуществления лицензируемого вида деятельности может совпадать с местом нахождения соискателя лицензии или лицензиата.
Место осуществления лицензируемого вида деятельности может совпадать с местом нахождения соискателя лицензии или лицензиата.
Основные принципы осуществления лицензирования
Согласно статье 4 Федерального закона от 04.05.2014 № 99-ФЗ основными принципами осуществления лицензирования являются:
1) обеспечение единства экономического пространства на территории Российской Федерации;
2) установление лицензируемых видов деятельности федеральным законом;
3) установление федеральными законами единого порядка лицензирования отдельных видов деятельности на территории Российской Федерации;
4) установление исчерпывающих перечней лицензионных требований в отношении лицензируемых видов деятельности положениями о лицензировании конкретных видов деятельности;
5) открытость и доступность информации о лицензировании, за исключением информации, распространение которой запрещено или ограничено в соответствии с законодательством Российской Федерации;
6) недопустимость взимания с соискателей лицензий и лицензиатов платы за осуществление лицензирования, за исключением уплаты государственной пошлины в размерах и в порядке, которые установлены законодательством Российской Федерации о налогах и сборах;
7) соблюдение законности при осуществлении лицензирования.
Чтобы читать дальше, купите книгу.
Стоимость:
Положение о лицензировании фармацевтической деятельности в Кыргызской Республике (Утверждено постановлением Правительства Кыргызской Республики от 6 февраля 1998 года N 63)
Главная Нормативные правовые акты Положение о лицензировании фармацевтической деятельности в Кыргызской Республике (Утверждено постановлением Правительства Кыргызской Республики от 6 февраля 1998 года N 63)
| Редакция: 31.05.200124.08.200014.03.200028.05.199806.02.1998 кыргызча | на русском |
УТРАТИЛО СИЛУ
в соответствии с постановлением Правительства КР
от 31 мая 2001 года N 260
Утверждено
постановлением Правительства
Кыргызской Республики
от 6 февраля 1998 года N 63
ПОЛОЖЕНИЕ
о лицензировании фармацевтической деятельности,
производства и реализации медицинской техники
(В редакции постановлений Правительства КР от
28 мая 1998 года N 308, 14 марта 2000 года N 137,
24 августа 2000 года N 519)
Настоящее Положение разработано в соответствии с Законами
Кыргызской Республики "О лицензировании", "Об охране здоровья
народа в Кыргызской Республике", "О медицинском страховании граждан
в Кыргызской Республике", "О лекарственных средствах",
постановлением Правительства Кыргызской Республики от 26 мая 1997 года
N 293 "О лицензировании отдельных видов деятельности".
I. Общие положения
1. Настоящим Положением регулируются порядок и условия
лицензирования юридических и физических лиц независимо от их форм
собственности и ведомственной принадлежности, занимающихся
фармацевтической деятельностью, производством и реализацией
медицинской техники в Кыргызской Республике.
2. Обязательному лицензированию подлежит деятельность юридических
и физических лиц независимо от их форм собственности,
административной и ведомственной принадлежности, осуществляющих
фармацевтическую деятельность, производство и реализацию медицинской
техники на территории Кыргызской Республики.
3. Иностранные юридические и физические лица, а также лица без
гражданства получают лицензии на заявленный вид деятельности на
таких же условиях и в таком же порядке, как и юридические и
физические лица Кыргызской Республики. Лицензии, полученные в других государствах, на территории
Кыргызской Республики признаются при условии заключения
соответствующих межгосударственных соглашений.
4. Лицензия является официальным документом, выдаваемым
Министерством здравоохранения Кыргызской Республики, который дает
право его владельцу на осуществление указанного в нем вида
деятельности.
5. Лицензия выдается за подписью курирующего заместителя Министра
здравоохранения Кыргызской Республики.
6. Лицензия является именной (неотчуждаемой), передача ее другому
юридическому или физическому лицу и снятие копий с нее запрещается.
В случае осуществления деятельности лицензиата на нескольких
территориально обособленных объектах в аттестационных сертификатах,
выданных органом, уполномоченным на ведение лицензионной
деятельности, указывается месторасположение каждого объекта.
Лицензии, полученные в других государствах, на территории
Кыргызской Республики признаются при условии заключения
соответствующих межгосударственных соглашений.
4. Лицензия является официальным документом, выдаваемым
Министерством здравоохранения Кыргызской Республики, который дает
право его владельцу на осуществление указанного в нем вида
деятельности.
5. Лицензия выдается за подписью курирующего заместителя Министра
здравоохранения Кыргызской Республики.
6. Лицензия является именной (неотчуждаемой), передача ее другому
юридическому или физическому лицу и снятие копий с нее запрещается.
В случае осуществления деятельности лицензиата на нескольких
территориально обособленных объектах в аттестационных сертификатах,
выданных органом, уполномоченным на ведение лицензионной
деятельности, указывается месторасположение каждого объекта.
7. Бланк лицензии имеет степень защищенности, учетную серию и
номер, изготавливается типографским способом и является документом
строгой отчетности. Учет и хранение бланков лицензий осуществляется
органом, уполномоченным на ведение лицензионной деятельности.
8. Осуществление фармацевтической деятельности, производство и
реализация медицинской техники без наличия лицензии Министерства
здравоохранения Кыргызской Республики запрещается.
9. Государственное лицензирование юридических и физических лиц,
осуществляющих фармацевтическую деятельность, производство и
реализацию медицинской техники, производится департаментом
лекарственного обеспечения и медицинской техники при Министерстве
здравоохранения Кыргызской Республики.
10. Заявляемая деятельность на основании лицензии может
ограничиваться определенной территорией Кыргызской Республики или
распространтьсяна всю ее территорию.
11. Лицензии на осуществление указанных видов деятельности
выдаются без ограничения срока.
12. Виды деятельности, подлежащие лицензированию:
- фармацевтическая деятельность;
- производство и реализация медицинской техники.
13. В понятие "фармацевтическая деятельность" входит изготовление
и реализация лекарственных средств, вакцин, сывороток и медикаментов.
14. Лицензия выдается отдельно на каждый вид деятельности,
указанный в пункте 12 настоящего Положения.
15. Действие лицензии не распространяется на других лиц,
осуществляющих деятельность совместно с лицензиатом, в том числе по
договору о сотрудничестве, а также на юридических лиц, одним из
учредителей которых является лицензиат.
II. Порядок выдачи лицензий
16. Процедура лицензирования включает в себя анализ представленных
документов, экспертизу объекта на соответствие условиям
лицензирования и выдачу лицензии. Выдача лицензий осуществляется на платной основе. Плата за выдачу
лицензий взимается в следующих размерах: с юридических лиц - 1000
сомов; с физических лиц - 500 сомов.
17. Для получения лицензии юридические и физические лица
представляют документы согласно приложению.
При необходимости орган, уполномоченный на ведение лицензионной
деятельности, имеет право запросить и получить информацию,
необходимую для осуществления лицензирования и контроля за
деятельностью юридических и физических лиц, занимающихся
фармацевтической деятельностью, производством и реализацией
медицинской техники на территории Кыргызской Республики.
18. Юридические и физические лица несут ответственность за
достоверность представленных сведений в соответствии с
законодательством Кыргызской Республики.
19. Департамент лекарственного обеспечения и медицинской техники
при Министерстве здравоохранения Кыргызской Республики ведет реестр
выданных, приостановленных и аннулированных лицензий.
Выдача лицензий осуществляется на платной основе. Плата за выдачу
лицензий взимается в следующих размерах: с юридических лиц - 1000
сомов; с физических лиц - 500 сомов.
17. Для получения лицензии юридические и физические лица
представляют документы согласно приложению.
При необходимости орган, уполномоченный на ведение лицензионной
деятельности, имеет право запросить и получить информацию,
необходимую для осуществления лицензирования и контроля за
деятельностью юридических и физических лиц, занимающихся
фармацевтической деятельностью, производством и реализацией
медицинской техники на территории Кыргызской Республики.
18. Юридические и физические лица несут ответственность за
достоверность представленных сведений в соответствии с
законодательством Кыргызской Республики.
19. Департамент лекарственного обеспечения и медицинской техники
при Министерстве здравоохранения Кыргызской Республики ведет реестр
выданных, приостановленных и аннулированных лицензий.
20. Надлежащим образом оформленное заявление с приложенными к нему
документами, необходимыми для получения лицензии, регистрируется в
день его подачи.
Решение о выдаче или отказе в выдаче лицензии принимается органами
лицензирования в течение 30 дней со дня регистрации заявления со
всеми необходимыми документами.
21. Мотивированный ответ об отказе в выдаче лицензии
представляется заявителю в письменной форме в сроки, установленные
для выдачи лицензий.
Основанием для отказа в выдаче лицензии является:
- отсутствие у заявителя требуемых документов, предусмотренных
перечнем;
- наличие в документах, представленных заявителем, недостоверной
или искаженной информации;
- экспертное заключение, установившее несоответствие условий
требованиям, предъявляемым к осуществлению соответствующего вида
деятельности;
- отсутствие документов, подтверждающих оплату лицензионного
сбора. 22. При ликвидации юридического лица или прекращении деятельности
физического лица в качестве предпринимателя выданная лицензия
теряет свою юридическую силу.
23. В случае утраты лицензии выдается ее дубликат с оплатой 50
процентов от суммы, уплаченной за лицензию.
24. При изменении организационно-правовой формы, наименования,
юридического адреса и иных реквизитов лицензиата, не связанных с
изменением условий осуществления данного вида деятельности, действие
лицензии сохраняется до конца указанного срока. Лицензиат обязан в 15-
дневный срок со дня реорганизации (изменения) подать заявление о
переоформлении лицензии. За переоформление лицензии взимается плата
в размере 100 сомов.
III. Обязательные лицензионные условия и требования
25. Лицензии на осуществление фармацевтической деятельности
получают физические лица с фармацевтическим образованием и
юридические лица, в штате которых состоят специалисты с
фармацевтическим образованием.
22. При ликвидации юридического лица или прекращении деятельности
физического лица в качестве предпринимателя выданная лицензия
теряет свою юридическую силу.
23. В случае утраты лицензии выдается ее дубликат с оплатой 50
процентов от суммы, уплаченной за лицензию.
24. При изменении организационно-правовой формы, наименования,
юридического адреса и иных реквизитов лицензиата, не связанных с
изменением условий осуществления данного вида деятельности, действие
лицензии сохраняется до конца указанного срока. Лицензиат обязан в 15-
дневный срок со дня реорганизации (изменения) подать заявление о
переоформлении лицензии. За переоформление лицензии взимается плата
в размере 100 сомов.
III. Обязательные лицензионные условия и требования
25. Лицензии на осуществление фармацевтической деятельности
получают физические лица с фармацевтическим образованием и
юридические лица, в штате которых состоят специалисты с
фармацевтическим образованием.
Лицензии на производство и реализацию
медицинской техники получают юридические и физические лица, персонал
которых имеет соответствующее образование.
26. Объекты лицензируемых юридических и физических лиц должны быть
аттестованы в обязательном порядке. Порядок аттестации
разрабатывается и утверждается Министерством здравоохранения
Кыргызской Республики
27. Обязательными лицензионными условиями при осуществлении
фармацевтической деятельности, наряду с перечисленными в пунктах 25
и 26 настоящего Положения, являются:
- соблюдение законодательства Кыргызской Республики:
экологических, санитарных, гигиенических, противопожарных норм и
правил;
- выполнение предписаний, установленных в нормативно-правовых
актах, регулирующих порядок контроля и сертификации;
- наличие документов, подтверждающих право собственности, или
договора аренды помещения;
- наличие сертификатов у специалистов, состоящих в штате
лицензиата.
IV. Контроль за соблюдением лицензионных условий
и ответственность за нарушение порядка лицензирования
28. Контроль за деятельностью лицензиата осуществляет департамент
лекарственного обеспечения и медицинской техники при Министерстве
здравоохранения Кыргызской Республики, а также другие государственные
органы в пределах прав, предоставленных законодательством Кыргызской
Республики.
29. В компетенцию департамента лекарственного обеспечения и
медицинской техники при Министерстве здравоохранения Кыргызской
Республики, осуществляющего контроль, входит:
- проверка деятельности лицензиатов по соблюдению ими лицензионных
условий, нормативно-правовых актов, регулирующих лицензируемые виды
деятельности;
- запрос и получение от лицензиатов необходимых сведений, справок
по вопросам, возникшим при проведении проверок;
- составление по результатам проверок актов (протоколов) с
указанием конкретных нарушений и сроков их устранения;
- вынесение предупреждений лицензиату об устранении выявленных
нарушений;
- приостановление действия лицензий. 30. Руководство лицензиата при проведении проверки обязано
обеспечить беспрепятственный доступ в занимаемое помещение,
предоставлять требуемые документы, касающиеся лицензируемой
деятельности, создавать нормальные условия для работы представителя
контролирующего органа.
V. Приостановление действия лицензии или ее отзыв
31. Действие лицензии приостанавливается в случаях:
- нарушения лицензиатом условий действия лицензии;
- невыполнения лицензиатом предписаний или распоряжений
государственных контролирующих органов (госпожарнадзора, СЭС,
налоговой инспекции, правоохранительных органов) в соответствии с
законодательством Кыргызской Республики;
- необоснованного отказа лицензиата представить необходимые
документы, затребованные в порядке контроля за исполнением лицензии
контролирующими службами или органами государственного контроля;
- приостановления или отзыва сертификата специалиста или
аттестационного сертификата объекта осуществления фармацевтической
деятельности, производства и реализации медицинской техники.
30. Руководство лицензиата при проведении проверки обязано
обеспечить беспрепятственный доступ в занимаемое помещение,
предоставлять требуемые документы, касающиеся лицензируемой
деятельности, создавать нормальные условия для работы представителя
контролирующего органа.
V. Приостановление действия лицензии или ее отзыв
31. Действие лицензии приостанавливается в случаях:
- нарушения лицензиатом условий действия лицензии;
- невыполнения лицензиатом предписаний или распоряжений
государственных контролирующих органов (госпожарнадзора, СЭС,
налоговой инспекции, правоохранительных органов) в соответствии с
законодательством Кыргызской Республики;
- необоснованного отказа лицензиата представить необходимые
документы, затребованные в порядке контроля за исполнением лицензии
контролирующими службами или органами государственного контроля;
- приостановления или отзыва сертификата специалиста или
аттестационного сертификата объекта осуществления фармацевтической
деятельности, производства и реализации медицинской техники. 32. В 5-дневный срок со дня принятия решения о приостановлении
действия или отзыва лицензии в письменной форме об этом решении
информируется лицензиат, территориальные органы Государственной
налоговой инспекции при Министерстве финансов Кыргызской Республики,
управления здравоохранения областей, города Бишкек.
33. Приостановление действия лицензии производится до устранения
нарушений, но не более чем на 3 месяца. В случае устранения
обстоятельств, повлекших приостановление действия лицензии, ее
действие может быть возобновлено после принятия Министерством
здравоохранения Кыргызской Республики соответствующего решения, о
котором не позднее чем в 5-дневный срок должны быть оповещены
лицензиат и вышеупомянутые органы.
34. Лицензия отзывается в случаях:
- непринятия мер по устранению допущенных нарушений в
установленный срок;
- неисполнения лицензиатом требований, содержащихся в лицензии;
- передачи лицензии другому юридическому или физическому лицу или
расширения сферы осуществления деятельности за счет территориально
обособленных объектов, незарегистрированных в органе лицензирования;
- запрещения судом лицензиату заниматься фармацевтической
деятельностью, производством и реализацией медицинской техники;
- реализации и хранения недоброкачественных, незарегистрированных
лекарственных средств, медицинской техники, изделий медицинского
назначения.
32. В 5-дневный срок со дня принятия решения о приостановлении
действия или отзыва лицензии в письменной форме об этом решении
информируется лицензиат, территориальные органы Государственной
налоговой инспекции при Министерстве финансов Кыргызской Республики,
управления здравоохранения областей, города Бишкек.
33. Приостановление действия лицензии производится до устранения
нарушений, но не более чем на 3 месяца. В случае устранения
обстоятельств, повлекших приостановление действия лицензии, ее
действие может быть возобновлено после принятия Министерством
здравоохранения Кыргызской Республики соответствующего решения, о
котором не позднее чем в 5-дневный срок должны быть оповещены
лицензиат и вышеупомянутые органы.
34. Лицензия отзывается в случаях:
- непринятия мер по устранению допущенных нарушений в
установленный срок;
- неисполнения лицензиатом требований, содержащихся в лицензии;
- передачи лицензии другому юридическому или физическому лицу или
расширения сферы осуществления деятельности за счет территориально
обособленных объектов, незарегистрированных в органе лицензирования;
- запрещения судом лицензиату заниматься фармацевтической
деятельностью, производством и реализацией медицинской техники;
- реализации и хранения недоброкачественных, незарегистрированных
лекарственных средств, медицинской техники, изделий медицинского
назначения. 35. Лицензиаты несут ответственность за нарушение или ненадлежащее
исполнение настоящего Положения в соответствии с законодательством
Кыргызской Республики.
Приложение
к Положению о лицензировании
фармацевтической деятельности
в Кыргызской Республики
ПЕРЕЧЕНЬ
документов, представляемых в департамент
лекарственного обеспечения и медицинской техники
при Министерстве здравоохранения Кыргызской Республики
для прохождения лицензирования юридическими и физическими
лицами, осуществляющими фармацевтическую деятельность
1. Заявление на имя директора департамента лекарственного
обеспечения и медицинской техники при Министерстве здравоохранения
Кыргызской Республики о выдаче лицензии по установленной форме.
35. Лицензиаты несут ответственность за нарушение или ненадлежащее
исполнение настоящего Положения в соответствии с законодательством
Кыргызской Республики.
Приложение
к Положению о лицензировании
фармацевтической деятельности
в Кыргызской Республики
ПЕРЕЧЕНЬ
документов, представляемых в департамент
лекарственного обеспечения и медицинской техники
при Министерстве здравоохранения Кыргызской Республики
для прохождения лицензирования юридическими и физическими
лицами, осуществляющими фармацевтическую деятельность
1. Заявление на имя директора департамента лекарственного
обеспечения и медицинской техники при Министерстве здравоохранения
Кыргызской Республики о выдаче лицензии по установленной форме. 2. Копия Устава юридических лиц.
3. Копия свидетельства о государственной регистрации, выданного
Министерством юстиции Кыргызской Республики (для юридических лиц).
4. Копия документов, подтверждающих право собственности, или
договора аренды помещения.
5. Копия свидетельства о государственной регистрации частного
предпринимателя в территориальных органах Национального
статистического комитета Кыргызской Республики (для физических лиц).
6. Копия заключения органов государственного пожарного надзора о
состоянии противопожарной безопасности используемых помещений.
7. Копия заключения санитарно-гигиенической экспертизы о
пригодности используемого для заявляемых видов деятельности помещения.
8. Утвержденный перечень нормативно-технической документации на
производимую продукцию.
9. Специалисты, имеющие фармацевтическое образование, представляют
копии:
- трудовой книжки;
- диплома об окончании высшего или среднего фармацевтического
учебного заведения;
- свидетельства или удостоверения о прохождении специализации или
усовершенствования;
- сертификата специалиста.
2. Копия Устава юридических лиц.
3. Копия свидетельства о государственной регистрации, выданного
Министерством юстиции Кыргызской Республики (для юридических лиц).
4. Копия документов, подтверждающих право собственности, или
договора аренды помещения.
5. Копия свидетельства о государственной регистрации частного
предпринимателя в территориальных органах Национального
статистического комитета Кыргызской Республики (для физических лиц).
6. Копия заключения органов государственного пожарного надзора о
состоянии противопожарной безопасности используемых помещений.
7. Копия заключения санитарно-гигиенической экспертизы о
пригодности используемого для заявляемых видов деятельности помещения.
8. Утвержденный перечень нормативно-технической документации на
производимую продукцию.
9. Специалисты, имеющие фармацевтическое образование, представляют
копии:
- трудовой книжки;
- диплома об окончании высшего или среднего фармацевтического
учебного заведения;
- свидетельства или удостоверения о прохождении специализации или
усовершенствования;
- сертификата специалиста. 10. Документ, подтверждающий оплату сбора за лицензию.
11. Документы, подтверждающие регистрацию и уплату страховых
взносов в органах Социального фонда Кыргызской Республики.
10. Документ, подтверждающий оплату сбора за лицензию.
11. Документы, подтверждающие регистрацию и уплату страховых
взносов в органах Социального фонда Кыргызской Республики.
Итоги типов лицензий — Аптечный совет штата Калифорния
| Тип лицензии | Текущие лицензии |
|---|---|
| Назначенные представители (EXC) | 2 814 |
| Назначенный ветеринарный представитель (EXV) | 54 |
| Назначенные представители-3PL (DRL) | 419 |
| Назначенный представитель-обратный дистрибьютор (DRR) | 10 |
| Назначенный фельдшер (DPM) | 3 |
| Стажер-фармацевт (INT) | 5 788 |
| Фармацевт (RPH) | 49 458 |
| Фармацевт передовой практики (APH) | 1 084 |
| Фармацевт (ТКП) | 68 129 |
| Автоматизированная система доставки лекарств (ADD(AUD)) | 1 035 |
| Автоматизированная система доставки лекарств (ADD(APD)) | 58 |
| Автоматизированная система доставки лекарств EMS (ADE) | 1 |
| Автоматизированная система выдачи лекарств 340B Clinic (ADC) | 0 |
| Государственная централизованная больничная упаковка (CHE) | 2 |
| Централизованная больничная упаковка (CHP) | 9 |
| Клиника (CLN) | 1 253 |
| Освобожденные клиники (CLE) | 928 |
| Аптечная комната (DRM) | 20 |
| Освобождение от наркологического кабинета (DRE) | 10 |
| Больницы (HSP) | 394 |
| Освобождение больниц (HPE) | 78 |
| Больничный сателлитный стерильный компаунд (SCP) | 4 |
| Госпиталь Сателлит, освобожденный от стерильных компаундов (SCE) | 4 |
| Игла и шприц для подкожных инъекций (HYP) | 237 |
| Исправительная аптека (LCF) | 59 |
| Центр аутсорсинга (OSF) | 4 |
| Механизм аутсорсинга для нерезидентов (NSF) | 20 |
| Аптека (PHY) | 6 243 |
| Государственная аптека (PHE) | 139 |
| Аптека Нерезидент (NRP) | 588 |
| Аптека удаленного отпуска (PHR) | 2 |
| Стерильный компаунд (LSC) | 729 |
| Стерильная рецептура, принадлежащая государству (LSE) | 104 |
| Стерильная рецептура для нерезидентов (NSC) | 55 |
| Посредник по сбору и распределению излишков лекарств (МСП) | 1 |
| Сторонние поставщики логистических услуг (TPL) | 40 |
| Сторонние поставщики логистических услуг-нерезидентов (NPL) | 122 |
| Ветеринарная розничная торговля продуктами питания и лекарствами для животных (VET) | 21 |
| Оптовики (WLS) | 545 |
| Освобождение оптовиков (WLE) | 13 |
| Оптовики-нерезиденты (OSD) | 785 |
| Итого | 140 227 |
Обновлено 27. 10.22
10.22
Типы лицензий | FDA
FDA ищет коммерческих партнеров, заинтересованных в разработке и маркетинге технологий , созданных учеными FDA.
FDA предлагает несколько типов лицензионных соглашений:
Лицензии на внутреннее коммерческое использование — предоставляет лицензиату неисключительное право создавать и использовать изобретение только для внутреннего использования. Эти лицензии не дают права продавать или иным образом распространять изобретение, но позволяют лицензиату использовать изобретение в своей коммерческой деятельности по развитию.
Лицензия на биологические материалы (BML) — позволяет компании лицензировать биологические материалы, разработанные FDA, патентная защита которых не может быть или не будет получена. Этот тип лицензии обычно не является исключительным и облегчает коммерческое развитие биологических материалов, разработанных в лабораториях FDA. FDA предлагает два вида BML:
- Лицензия на биологические материалы, используемая в ограниченных коммерческих целях
- Лицензия на биологические материалы — только для внутренних исследовательских целей.
 Лицензиат не может распространять изобретение, но может использовать его в своих коммерческих разработках.
Лицензиат не может распространять изобретение, но может использовать его в своих коммерческих разработках.
Лицензии на коммерческую оценку — предоставляет неисключительное право на создание и использование технологии с целью оценки ее коммерческого потенциала. Лицензия выдается на ограниченное количество месяцев и не дает права продавать или иным образом распространять технологию. Компании обязаны получить коммерческую лицензию для дальнейшего использования и/или развития изобретения.
Неисключительные патентные лицензии — позволяет компании коммерциализировать запатентованную или запатентованную технологию. Неисключительное лицензирование позволяет использовать несколько лицензиатов.
FDA имеет два вида неисключительных патентных лицензий.
- Неисключительная патентная лицензия
- Неисключительная патентная лицензия только для внутренних исследовательских целей. Лицензиат не может распространять технологию, но может использовать ее в своих коммерческих разработках.


 Лицензии, полученные в других государствах, на территории
Кыргызской Республики признаются при условии заключения
соответствующих межгосударственных соглашений.
4. Лицензия является официальным документом, выдаваемым
Министерством здравоохранения Кыргызской Республики, который дает
право его владельцу на осуществление указанного в нем вида
деятельности.
5. Лицензия выдается за подписью курирующего заместителя Министра
здравоохранения Кыргызской Республики.
6. Лицензия является именной (неотчуждаемой), передача ее другому
юридическому или физическому лицу и снятие копий с нее запрещается.
В случае осуществления деятельности лицензиата на нескольких
территориально обособленных объектах в аттестационных сертификатах,
выданных органом, уполномоченным на ведение лицензионной
деятельности, указывается месторасположение каждого объекта.
Лицензии, полученные в других государствах, на территории
Кыргызской Республики признаются при условии заключения
соответствующих межгосударственных соглашений.
4. Лицензия является официальным документом, выдаваемым
Министерством здравоохранения Кыргызской Республики, который дает
право его владельцу на осуществление указанного в нем вида
деятельности.
5. Лицензия выдается за подписью курирующего заместителя Министра
здравоохранения Кыргызской Республики.
6. Лицензия является именной (неотчуждаемой), передача ее другому
юридическому или физическому лицу и снятие копий с нее запрещается.
В случае осуществления деятельности лицензиата на нескольких
территориально обособленных объектах в аттестационных сертификатах,
выданных органом, уполномоченным на ведение лицензионной
деятельности, указывается месторасположение каждого объекта.

 Выдача лицензий осуществляется на платной основе. Плата за выдачу
лицензий взимается в следующих размерах: с юридических лиц - 1000
сомов; с физических лиц - 500 сомов.
17. Для получения лицензии юридические и физические лица
представляют документы согласно приложению.
При необходимости орган, уполномоченный на ведение лицензионной
деятельности, имеет право запросить и получить информацию,
необходимую для осуществления лицензирования и контроля за
деятельностью юридических и физических лиц, занимающихся
фармацевтической деятельностью, производством и реализацией
медицинской техники на территории Кыргызской Республики.
18. Юридические и физические лица несут ответственность за
достоверность представленных сведений в соответствии с
законодательством Кыргызской Республики.
19. Департамент лекарственного обеспечения и медицинской техники
при Министерстве здравоохранения Кыргызской Республики ведет реестр
выданных, приостановленных и аннулированных лицензий.
Выдача лицензий осуществляется на платной основе. Плата за выдачу
лицензий взимается в следующих размерах: с юридических лиц - 1000
сомов; с физических лиц - 500 сомов.
17. Для получения лицензии юридические и физические лица
представляют документы согласно приложению.
При необходимости орган, уполномоченный на ведение лицензионной
деятельности, имеет право запросить и получить информацию,
необходимую для осуществления лицензирования и контроля за
деятельностью юридических и физических лиц, занимающихся
фармацевтической деятельностью, производством и реализацией
медицинской техники на территории Кыргызской Республики.
18. Юридические и физические лица несут ответственность за
достоверность представленных сведений в соответствии с
законодательством Кыргызской Республики.
19. Департамент лекарственного обеспечения и медицинской техники
при Министерстве здравоохранения Кыргызской Республики ведет реестр
выданных, приостановленных и аннулированных лицензий.
 22. При ликвидации юридического лица или прекращении деятельности
физического лица в качестве предпринимателя выданная лицензия
теряет свою юридическую силу.
23. В случае утраты лицензии выдается ее дубликат с оплатой 50
процентов от суммы, уплаченной за лицензию.
24. При изменении организационно-правовой формы, наименования,
юридического адреса и иных реквизитов лицензиата, не связанных с
изменением условий осуществления данного вида деятельности, действие
лицензии сохраняется до конца указанного срока. Лицензиат обязан в 15-
дневный срок со дня реорганизации (изменения) подать заявление о
переоформлении лицензии. За переоформление лицензии взимается плата
в размере 100 сомов.
III. Обязательные лицензионные условия и требования
25. Лицензии на осуществление фармацевтической деятельности
получают физические лица с фармацевтическим образованием и
юридические лица, в штате которых состоят специалисты с
фармацевтическим образованием.
22. При ликвидации юридического лица или прекращении деятельности
физического лица в качестве предпринимателя выданная лицензия
теряет свою юридическую силу.
23. В случае утраты лицензии выдается ее дубликат с оплатой 50
процентов от суммы, уплаченной за лицензию.
24. При изменении организационно-правовой формы, наименования,
юридического адреса и иных реквизитов лицензиата, не связанных с
изменением условий осуществления данного вида деятельности, действие
лицензии сохраняется до конца указанного срока. Лицензиат обязан в 15-
дневный срок со дня реорганизации (изменения) подать заявление о
переоформлении лицензии. За переоформление лицензии взимается плата
в размере 100 сомов.
III. Обязательные лицензионные условия и требования
25. Лицензии на осуществление фармацевтической деятельности
получают физические лица с фармацевтическим образованием и
юридические лица, в штате которых состоят специалисты с
фармацевтическим образованием.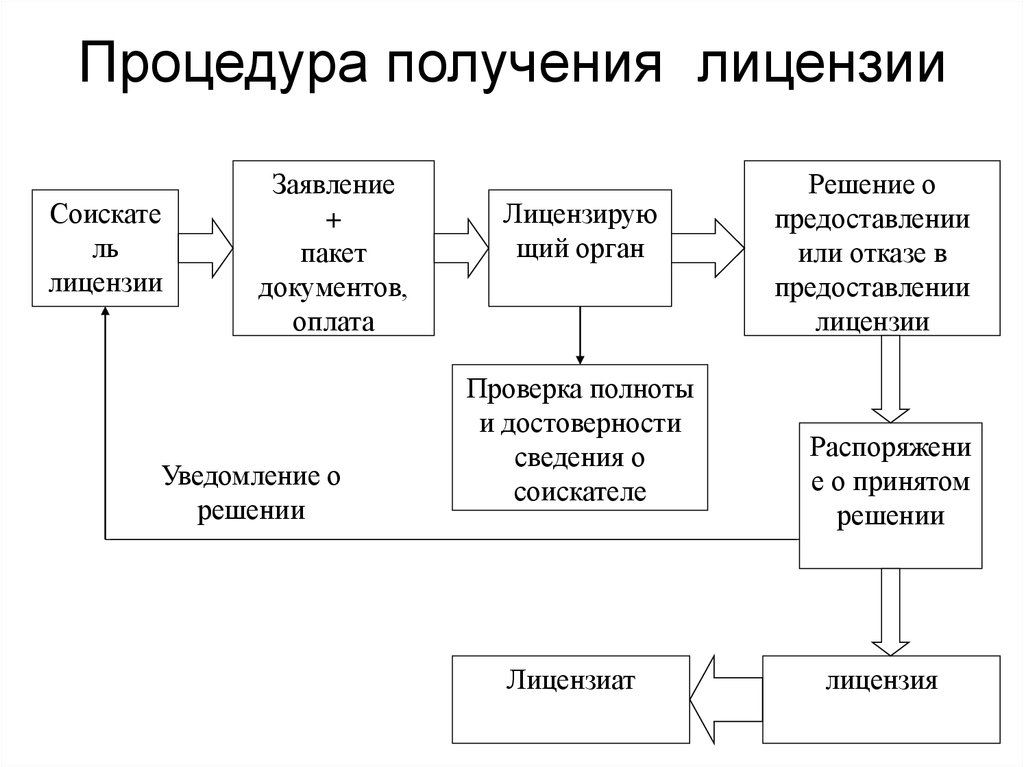

 30. Руководство лицензиата при проведении проверки обязано
обеспечить беспрепятственный доступ в занимаемое помещение,
предоставлять требуемые документы, касающиеся лицензируемой
деятельности, создавать нормальные условия для работы представителя
контролирующего органа.
V. Приостановление действия лицензии или ее отзыв
31. Действие лицензии приостанавливается в случаях:
- нарушения лицензиатом условий действия лицензии;
- невыполнения лицензиатом предписаний или распоряжений
государственных контролирующих органов (госпожарнадзора, СЭС,
налоговой инспекции, правоохранительных органов) в соответствии с
законодательством Кыргызской Республики;
- необоснованного отказа лицензиата представить необходимые
документы, затребованные в порядке контроля за исполнением лицензии
контролирующими службами или органами государственного контроля;
- приостановления или отзыва сертификата специалиста или
аттестационного сертификата объекта осуществления фармацевтической
деятельности, производства и реализации медицинской техники.
30. Руководство лицензиата при проведении проверки обязано
обеспечить беспрепятственный доступ в занимаемое помещение,
предоставлять требуемые документы, касающиеся лицензируемой
деятельности, создавать нормальные условия для работы представителя
контролирующего органа.
V. Приостановление действия лицензии или ее отзыв
31. Действие лицензии приостанавливается в случаях:
- нарушения лицензиатом условий действия лицензии;
- невыполнения лицензиатом предписаний или распоряжений
государственных контролирующих органов (госпожарнадзора, СЭС,
налоговой инспекции, правоохранительных органов) в соответствии с
законодательством Кыргызской Республики;
- необоснованного отказа лицензиата представить необходимые
документы, затребованные в порядке контроля за исполнением лицензии
контролирующими службами или органами государственного контроля;
- приостановления или отзыва сертификата специалиста или
аттестационного сертификата объекта осуществления фармацевтической
деятельности, производства и реализации медицинской техники. 32. В 5-дневный срок со дня принятия решения о приостановлении
действия или отзыва лицензии в письменной форме об этом решении
информируется лицензиат, территориальные органы Государственной
налоговой инспекции при Министерстве финансов Кыргызской Республики,
управления здравоохранения областей, города Бишкек.
33. Приостановление действия лицензии производится до устранения
нарушений, но не более чем на 3 месяца. В случае устранения
обстоятельств, повлекших приостановление действия лицензии, ее
действие может быть возобновлено после принятия Министерством
здравоохранения Кыргызской Республики соответствующего решения, о
котором не позднее чем в 5-дневный срок должны быть оповещены
лицензиат и вышеупомянутые органы.
34. Лицензия отзывается в случаях:
- непринятия мер по устранению допущенных нарушений в
установленный срок;
- неисполнения лицензиатом требований, содержащихся в лицензии;
- передачи лицензии другому юридическому или физическому лицу или
расширения сферы осуществления деятельности за счет территориально
обособленных объектов, незарегистрированных в органе лицензирования;
- запрещения судом лицензиату заниматься фармацевтической
деятельностью, производством и реализацией медицинской техники;
- реализации и хранения недоброкачественных, незарегистрированных
лекарственных средств, медицинской техники, изделий медицинского
назначения.
32. В 5-дневный срок со дня принятия решения о приостановлении
действия или отзыва лицензии в письменной форме об этом решении
информируется лицензиат, территориальные органы Государственной
налоговой инспекции при Министерстве финансов Кыргызской Республики,
управления здравоохранения областей, города Бишкек.
33. Приостановление действия лицензии производится до устранения
нарушений, но не более чем на 3 месяца. В случае устранения
обстоятельств, повлекших приостановление действия лицензии, ее
действие может быть возобновлено после принятия Министерством
здравоохранения Кыргызской Республики соответствующего решения, о
котором не позднее чем в 5-дневный срок должны быть оповещены
лицензиат и вышеупомянутые органы.
34. Лицензия отзывается в случаях:
- непринятия мер по устранению допущенных нарушений в
установленный срок;
- неисполнения лицензиатом требований, содержащихся в лицензии;
- передачи лицензии другому юридическому или физическому лицу или
расширения сферы осуществления деятельности за счет территориально
обособленных объектов, незарегистрированных в органе лицензирования;
- запрещения судом лицензиату заниматься фармацевтической
деятельностью, производством и реализацией медицинской техники;
- реализации и хранения недоброкачественных, незарегистрированных
лекарственных средств, медицинской техники, изделий медицинского
назначения. 35. Лицензиаты несут ответственность за нарушение или ненадлежащее
исполнение настоящего Положения в соответствии с законодательством
Кыргызской Республики.
Приложение
к Положению о лицензировании
фармацевтической деятельности
в Кыргызской Республики
ПЕРЕЧЕНЬ
документов, представляемых в департамент
лекарственного обеспечения и медицинской техники
при Министерстве здравоохранения Кыргызской Республики
для прохождения лицензирования юридическими и физическими
лицами, осуществляющими фармацевтическую деятельность
1. Заявление на имя директора департамента лекарственного
обеспечения и медицинской техники при Министерстве здравоохранения
Кыргызской Республики о выдаче лицензии по установленной форме.
35. Лицензиаты несут ответственность за нарушение или ненадлежащее
исполнение настоящего Положения в соответствии с законодательством
Кыргызской Республики.
Приложение
к Положению о лицензировании
фармацевтической деятельности
в Кыргызской Республики
ПЕРЕЧЕНЬ
документов, представляемых в департамент
лекарственного обеспечения и медицинской техники
при Министерстве здравоохранения Кыргызской Республики
для прохождения лицензирования юридическими и физическими
лицами, осуществляющими фармацевтическую деятельность
1. Заявление на имя директора департамента лекарственного
обеспечения и медицинской техники при Министерстве здравоохранения
Кыргызской Республики о выдаче лицензии по установленной форме. 2. Копия Устава юридических лиц.
3. Копия свидетельства о государственной регистрации, выданного
Министерством юстиции Кыргызской Республики (для юридических лиц).
4. Копия документов, подтверждающих право собственности, или
договора аренды помещения.
5. Копия свидетельства о государственной регистрации частного
предпринимателя в территориальных органах Национального
статистического комитета Кыргызской Республики (для физических лиц).
6. Копия заключения органов государственного пожарного надзора о
состоянии противопожарной безопасности используемых помещений.
7. Копия заключения санитарно-гигиенической экспертизы о
пригодности используемого для заявляемых видов деятельности помещения.
8. Утвержденный перечень нормативно-технической документации на
производимую продукцию.
9. Специалисты, имеющие фармацевтическое образование, представляют
копии:
- трудовой книжки;
- диплома об окончании высшего или среднего фармацевтического
учебного заведения;
- свидетельства или удостоверения о прохождении специализации или
усовершенствования;
- сертификата специалиста.
2. Копия Устава юридических лиц.
3. Копия свидетельства о государственной регистрации, выданного
Министерством юстиции Кыргызской Республики (для юридических лиц).
4. Копия документов, подтверждающих право собственности, или
договора аренды помещения.
5. Копия свидетельства о государственной регистрации частного
предпринимателя в территориальных органах Национального
статистического комитета Кыргызской Республики (для физических лиц).
6. Копия заключения органов государственного пожарного надзора о
состоянии противопожарной безопасности используемых помещений.
7. Копия заключения санитарно-гигиенической экспертизы о
пригодности используемого для заявляемых видов деятельности помещения.
8. Утвержденный перечень нормативно-технической документации на
производимую продукцию.
9. Специалисты, имеющие фармацевтическое образование, представляют
копии:
- трудовой книжки;
- диплома об окончании высшего или среднего фармацевтического
учебного заведения;
- свидетельства или удостоверения о прохождении специализации или
усовершенствования;
- сертификата специалиста. 10. Документ, подтверждающий оплату сбора за лицензию.
11. Документы, подтверждающие регистрацию и уплату страховых
взносов в органах Социального фонда Кыргызской Республики.
10. Документ, подтверждающий оплату сбора за лицензию.
11. Документы, подтверждающие регистрацию и уплату страховых
взносов в органах Социального фонда Кыргызской Республики.
 Лицензиат не может распространять изобретение, но может использовать его в своих коммерческих разработках.
Лицензиат не может распространять изобретение, но может использовать его в своих коммерческих разработках.
Об авторе